https://www.vidal.fr/actualites/30117-progestatifs-et-risque-de-meningiome-un-effet-de-classe.html
Progestatifs et risque de méningiome : un effet de classe ?
Le comité d’experts chargé d’évaluer le risque de méningiome associé à 4 progestatifs (diénogest, dydrogestérone, médrogestone, progestérone) a émis les premières recommandations pour sécuriser l’usage de ces médicaments, dans l’attente de données complémentaires.
Un mois après sa création, le comité d’experts réuni par l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) propose des recommandations préliminaires pour réduire le risque potentiel de méningiome en cas d’utilisation de quatre progestatifs (diénogest, dydrogestérone, médrogestone, progestérone) utilisés en gynécologie (troubles gynécologiques, traitement hormonal substitutif) :
- ces médicaments sont désormais contre-indiqués en cas d’antécédent de méningiome ou de méningiome existant, sauf exception à évaluer en réunion de concertation pluridisciplinaire ;
- avant toute nouvelle prescription de progestatifs ou prescription d’un progestatif en relais de la cyprotérone, chlormadinone ou nomégestrol, il est recommandé de vérifier l’ensemble des progestatifs déjà utilisés et leur durée d’utilisation ;
- le traitement doit être prescrit à la dose minimale efficace avec une durée d’utilisation la plus courte possible ;
- une réévaluation annuelle du traitement est nécessaire ;
- l’imagerie par résonance magnétique (IRM) cérébrale est requise en cas de signes cliniques neurologiques évocateurs d’un méningiome.
Ces recommandations s’ajoutent à celles déjà applicables pour les médicaments à base de cyprotérone, de nomégestrol et de chlormadinone. Elles sont susceptibles d’évoluer en fonction des résultats des études épidémiologiques en cours, un effet de classe ne pouvant être exclu actuellement.
Un mois après sa mise en place par l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) [1], le comité scientifique temporaire (CST) d’experts a émis les premières recommandations [2] visant à sécuriser l’utilisation de quatre progestatifs (cf. Encadré). Le risque de méningiome ne peut pas être exclu avec les progestatifs autres que ceux à base d’acétate de cyprotérone, nomégestrol et chlormadinone. Des études sont actuellement en cours pour évaluer ce risque.
Ces progestatifs sont utilisés :
- dans le traitement des pathologies gynécologiques (endométriose, fibromes, règles particulièrement longues et/ou abondantes, troubles du cycle),
- dans le traitement hormonal substitutif (y compris ménopause) ;
- en obstétrique (stérilité par insuffisance lutéale, avortements à répétition).
| Progestatif et dosage | Spécialités commercialisées (mars 2023) |
| diénogest 2 mg | génériques de VISANNE (qui n’est plus commercialisé) : DIMETRUM, ENDOVELA, SAWIS
NB : en France, il existe également deux contraceptifs associant diénogest 2 mg et éthinylestradiol (OEDIEN, MISOLFA) ou diénogest (2 et 3 mg) et estradiol (QLAIRA). |
| dydrogestérone 10 mg | DUPHASTON
NB. La dydrogestérone entre également dans la composition de CLIMASTON, en association avec l’estradiol. |
| médrogestérone 10 mg | COLPRONE |
| progestérone 100 mg et 200 mg | UTROGESTAN (100 mg et 200 mg), ESTIMA (100 et 200 mg), PROGESTAN (100 et 200 mg), PROGESTERONE BIOGARAN (100 et 200 mg), PROGESTERONE MYLAN 100 mg |
Risque de méningiome : un effet de classe ne peut être exclus avec les progestatifs
Depuis 2019, des études épidémiologiques, notamment françaises, ont permis de préciser la relation entre les progestatifs à base de nomégestrol (LUTENYL), de chlormadinone (LUTERAN) et de cyprotérone (ANDROCUR) et le risque de méningiome. Ce risque augmente avec la dose reçue, et la durée de traitement. La France, puis l’Union européenne, ont mis en place un ensemble de mesures pour encadrer l’utilisation de ces médicaments (cf. notre article du 17 novembre 2022).
En France, une surveillance renforcée menée sur l’ensemble des progestatifs a mis en évidence des cas de méningiome survenus lors de traitements par d’autres progestatifs, suggérant un effet de classe.
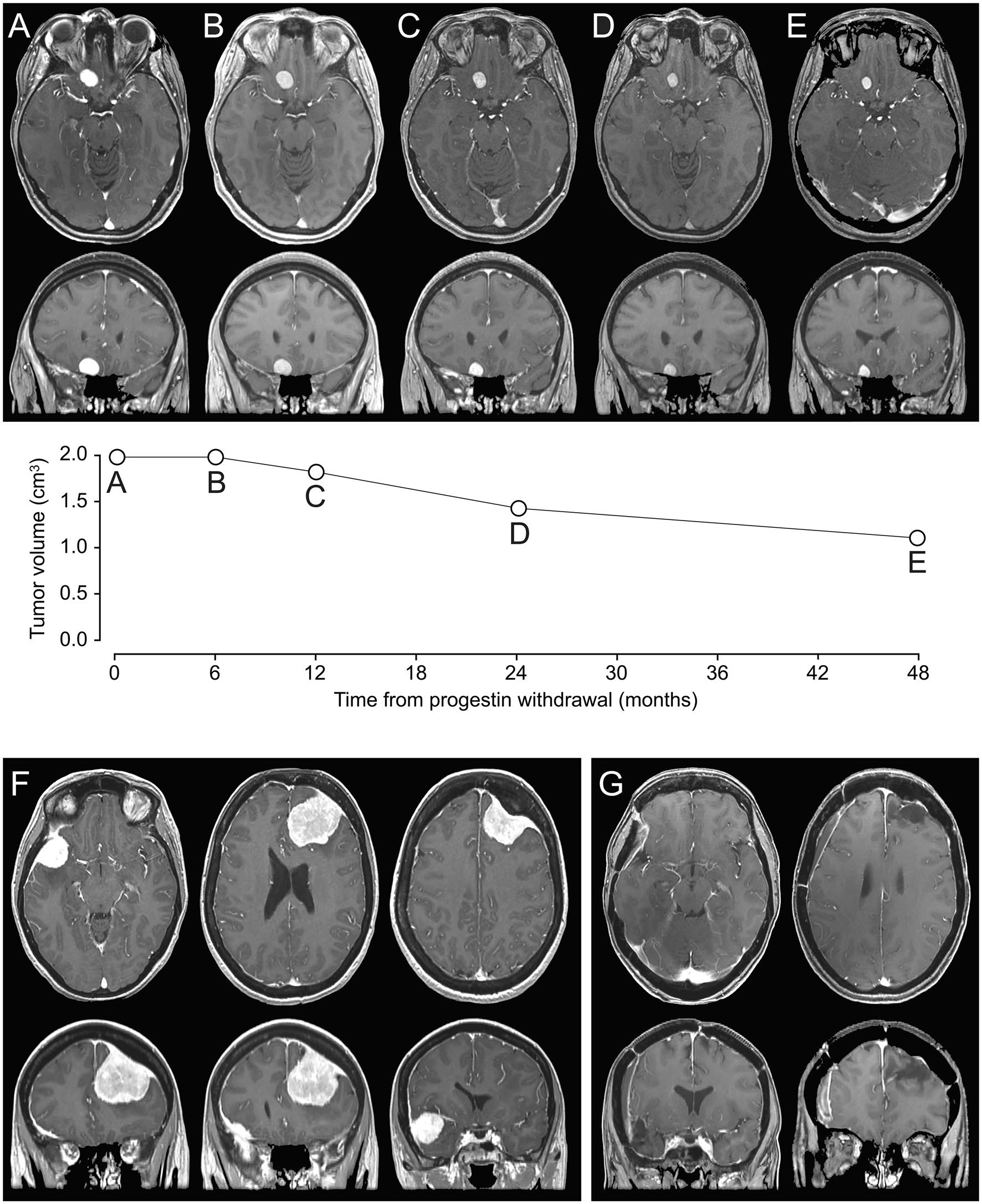
« Parmi les cas de méningiomes déclarés sous traitement progestatif, ceux rapportés avec la médrogestone (COLPRONE) et la progestérone à 100 mg et 200 mg (UTROGESTAN et génériques) sont particulièrement suggestifs d’un rôle de ces médicaments compte tenu de la stabilisation ou la régression tumorale à l’arrêt du traitement », commente l’ANSM.
Ces premières constatations ont conduit à mentionner le risque de méningiome dans le résumé des caractéristiques du produit (RCP) et la notice de COLPRONE.
L’ANSM a saisi le comité européen de pharmacovigilance (PRAC) afin d’initier une évaluation européenne.
Recommandations pour sécuriser l’utilisation des progestatifs
Les premières recommandations du CST ont pour objectif de sécuriser l’utilisation des progestatifs chez les femmes qui en ont besoin :
- situation de contre-indication : en cas d’antécédent de méningiome ou de méningiome existant, l’introduction d’un traitement progestatif est contre-indiquée, sauf exception à évaluer en réunion de concertation pluridisciplinaire (constituée de gynécologue et/ou endocrinologue et neurochirurgien) sur la base du rapport bénéfice/risque individuel pour les personnes traitées et de la présence ou non d’alternatives thérapeutiques ;
- prendre en compte les traitements antérieurs par progestatifs : avant toute nouvelle prescription ou switch entre progestatifs (notamment le relais après un traitement par cyprotérone, nomégestrol ou chlormadinone), vérifier l’ensemble des progestatifs déjà utilisés et leur durée d’utilisation au cours de la vie de la patiente ;
- durée et dose : le traitement doit être prescrit à la dose minimale efficace avec une durée d’utilisation la plus courte possible ;
- réévaluation de l’intérêt du traitement : l’intérêt à poursuivre le traitement doit être réévalué régulièrement (tous les ans), notamment aux alentours de la ménopause, le risque de méningiome augmentant fortement avec l’âge.
Pas d’IRM systématique, uniquement en cas de symptômes
Pour le moment, le CST recommande une IRM cérébrale uniquement en cas de signes cliniques neurologiques évocateurs d’un méningiome :
- maux de tête ;
- troubles de la vision, du langage, de la mémoire et de l’audition ;
- nausées ;
- vertiges ;
- convulsions ;
- perte de l’odorat ;
- faiblesse ou paralysie.
Pour rappel, l’IRM cérébrale chez les patientes traitées par chlormadinone et nomégestrol doit être réalisée quel que soit l’âge :
- à tout moment pendant ou après le traitement en cas de signes évocateurs de méningiomes ;
- au bout d’1 an de traitement lorsque le traitement nécessite d’être poursuivi, puis 5 ans après la première IRM, puis tous les 2 ans tant que le traitement est poursuivi ;
- à l’initiation du traitement en cas de facteurs de risque identifiés de méningiome (antécédent de radiothérapie encéphalique dans l’enfance ou neurofibromatose de type 2).
Un suivi périodique par IRM cérébrale est mis en place pour les patientes traitées par cyprotérone.
Une étude EPIPHARE en cours
Ces recommandations sont susceptibles d’évoluer afin de tenir compte des résultats de nouvelles études épidémiologiques.
Des études menées par le groupement d’intérêt scientifique (GIS) EPIPHARE sont actuellement en cours, et ont pour objectif de confirmer ou d’infirmer la relation entre progestatifs et méningiome, à partir des données de santé issues des bases de l’Assurance maladie.

 Lecture : 6 minutes
Lecture : 6 minutes