Étude conduite par Henri Malaize (1,2) · Thomas Samoyeau (2,3) · Marc Zanello (1,2,4) · Alexandre Roux (1,2,4) · Joseph Benzakoun (2,3,4) · Sophie Peeters (5) · Gilles Zah‑Bi (1,2) · Myriam Edjlali (2,3,4) · Arnault Tauziede‑Espariat (2,6) · Edouard Dezamis (1,2) · Eduardo Parraga (1,2) · Fabrice Chrétien (2,6) · Pascale Varlet (2,4,6) · Geneviève Plu‑Bureau (7,8) · Catherine Oppenheim (2,3,4) · sous la direction de Johan Pallud (1,2,4)
Objet
L’amélioration des connaissances sur les interactions entre les méningiomes et les progestatifs permet d’affiner la gestion de cet état spécifique. Nous avons évalué l’évolution dans le temps de la prise en charge des méningiomes associés à un progestatif.
Méthodes
Nous avons étudié rétrospectivement des patients adultes consécutifs qui avaient au moins un méningiome dans le cadre de la prise de progestatif (octobre 1995-octobre 2018) dans un centre Hospitalo-universitaire de neurochirurgie de l’adulte.
Résultats
71 femmes adultes présentant 125 méningiomes associés à un progestatif ont été incluses. Le nombre de patients atteints de méningiomes associés à un progestatif a augmenté au fil du temps (0,5/an avant 2008, 22,0/an après 2017). Le traitement par progestatif était une indication validée dans 27,0 % des cas. Une moyenne de 1,7 ± 1,2 méningiomes ont été découverts par patient (médiane 1, fourchette 1-6). La chirurgie a été pratiquée sur 36 (28,8 %) méningiomes et le classement histopathologique était de grade OMS 1 pour 61,1 % et de grade 2 pour 38,9 %. La prise en charge conservatrice des méningiomes a augmenté avec le temps (33,3 % avant 2008, 64,3 % après 2017) et le retrait du traitement progestatif a augmenté avec le temps (16,7 % avant 2008, 95,2 % après 2017). L’arrêt du traitement varie selon le dérivé progestatif utilisé (88,9 % avec l’acétate de cyprotérone, 84,6 % avec l’acétate de chlormadinone, 28,6 % avec l’acétate de nomégestrol, 66,7 % avec la combinaison de dérivés progestatifs). La principale raison de la prise en charge thérapeutique des méningiomes était la présence de signes cliniques. Parmi les 54 méningiomes gérés de manière conservatrice pour lesquels le progestatif avait été arrêté, le suivi par IRM a montré une régression dans 29,6 % des cas, une stabilité dans 68,5 % des cas et une croissance continue dans 1,9 % des cas.
Conclusions
La gestion conservatrice, y compris l’arrêt des traitements progestatifs, s’est développée au fil du temps avec des résultats prometteurs en termes d’efficacité et de sécurité.
Mots-clés : Acétate de chlormadinone ; Acétate de cyprotérone ; Méningiome; Neurochirurgie ; Acétate de nomégestrol ; Progestatif.
Précisions de l’association AMAVEA
Acétate de cyprotérone : Androcur
Acétate de chlormadinone : Lutéran
Acétate de nomégestrol : Lutényl
1 Department of Neurosurgery, Service de Neurochirurgie, GHU site Sainte-Anne, Paris, France
2 Université de Paris, Paris, France
3 Department of Neuroradiology, GHU site Sainte-Anne, Paris, France
4 Institut de Psychiatrie et Neurosciences de Paris (IPNP), UMR S1266, INSERM, IMA-BRAIN, Paris, France
5 Department of Neurosurgery, University of California, Los Angeles, Los Angeles, CA, USA
6 Department of Neuropathology, GHU site Sainte-Anne, Paris, France
7 Obstetrical, Perinatal and Pediatric Epidemiology Research Team, Center for Epidemiology and Biostatistics, INSERM U1153, Paris-Descartes University, Paris, France
8 Gynecology Endocrinology Unit, University Hospital Paris Centre, Cochin Hospital, APHP, Paris, France
Introduction
Les méningiomes sont l’une des tumeurs primaires du système nerveux central les plus fréquentes chez l’adulte [1]. Leur incidence est plus élevée chez les femmes (rapport de masculinité post-pubertaire de 2/1 ; 3,15/1 pendant les années de forte reproduction) [2].
L’utilisation à long terme de fortes doses cumulées de progestatif (c’est-à-dire un dérivé synthétique de la progestérone ayant une activité antiandrogène et de type progestatif), y compris l’avétate de cyprotérone, l’acétate de chlormadinone et l’acétate de nomégestrol, est connu pour favoriser le développement des méningiomes [3–10].
En France, l’acétate de cyprotérone est indiqué pour le traitement du cancer avancé de la prostate, la réduction des pulsions sexuelles dans les paraphilies, et l’hirsutisme féminin majeur [11]. L’acétate de chlormadinone est indiqué pour le traitement de troubles menstruels, de symptômes de la ménopause, de troubles endométriaux l’hyperplasie et l’endométriose [12]. L’acétate de nomégestrol est indiqué pour le traitement des troubles menstruels, les troubles préménopausiques, les hémorragies génitales fonctionnelles, et les fibromes utérins [13]. Les trois médicaments ont a été largement utilisé en dehors des indications autorisées pour l’acné ou l’alopécie féminine. Le lien entre des doses cumulées élevées de progestatif et la croissance du méningiome est établie depuis 2007 [14] et des cas de régression spontanée de méningiomes après des retraits de progestatif ont été signalés en 2008 pour l’acétate de chlormadinone [15], en 2010 pour l’acétate de cyprotérone [16-20], et en 2019 pour l’acétate de nomégestrol [21].
Ces avancées dans la connaissance des interactions entre les méningiomes et les progestatifs ont changé la prise en charge neurochirurgicale de cette affection spécifique. La présente étude observationnelle à centre unique fait état d’une analyse rétrospective de patients adultes consécutifs sous traitement progestatif, porteurs d’un méningiome et orientés vers la neurochirurgie. Nous avons évalué : (1) les caractéristiques des méningiomes ; (2) la prise en charge du traitement progestatif et (3) la gestion des méningiomes.
Matériel et méthodes
Source des données
Nous avons examiné nos dossiers de patients adultes qui ont hébergé au moins un méningiome dans le cadre de la prise de progestatif entre octobre 1995 et octobre 2018 (c’est-à-dire avant la politique de dépistage recommandée en France par les Agences nationale sdes médicaments et des produits de santé , à savoir l’Agence Nationale de Sécurité du Médicament et des produits de santé) et géré dans notre centre neurochirurgical tertiaire pour adultes. Les termes de recherche utilisés (en français) sont : méningiome ET/ OU méningiome ET/OU acétate ET/OU acétate ET/ OU cyprotérone ET/OU cyprotérone ET/OU androcur ® ET/OU nomégestrol ET/OU nomégestrol ET/ OU lutényl® ET/OU lutenyl® ET/OU chlormadinone ET/OU lutéran® ET/OU luteran®. Cette étude a reçu les autorisations nécessaires (IRB #1 : 2020/08) de la commission de révision institutionnelle (IRB00011687). L’obligation d’obtenir un consentement éclairé a été levée pour cette étude rétrospective d’observation selon la législation.
Collecte de données
Les données ont été obtenues à partir des dossiers médicaux. Le patient et les caractéristiques associées au progestatif recueillies à l’époque du diagnostic par imagerie, sont notamment : sexe, âge, symptômes au moment du diagnostic (asymptomatique, crise d’épilepsie, augmentation de la pression intracrânienne pression, déficit neurologique), Karnofsky Performance Status (KPS), le traitement avec un progestatif (molécule, raison pour le traitement, la dose cumulative, la date d’administration, l’heure intervalle entre le traitement et le diagnostic de méningiome), les caractéristiques du méningiome (nombre, localisation, volume, grade). Les caractéristiques du traitement et du suivi comprenaient : durée de suivi, évolution du méningiome sur l’imagerie de suivi, la gestion de chaque méningiome (conservateur, chirurgie, radiothérapie), la gestion du progestatif (retrait du traitement ou non), et les complications liées au traitement. Tous les dossiers médicaux ont été examinés par un neurochirurgien junior (HM) et validé par un neurochirurgien senior (JP). Toutes les IRM ont été examinées par un neuroradiologiste junior (TS) et validé par un neuroradiologiste senior (JB).
Chaque lésion durale découverte par IRM et dont les caractéristiques d’imagerie sont cohérentes avec un méningiome sur au moins deux IRM successives était appelé par la suite « méningiome », avec ou sans examen histopathologique confirmation. Nous avons divisé la cohorte sur la base des connaissances publiées au moment du diagnostic des patients en utilisant les deux points de repère fondés sur des preuves : (1) 1 an après le premier rapport de la croissance des méningiomes après un traitement œstrogène-progestatif en décembre 2007 [2, 14] ; (2) 1 an après la première série d’affaires démontrer la stabilisation de la croissance et la régression des méningiomes après l’arrêt de l’acétate de cyprotérone en octobre 2015 [18]. Cette méthode a donné les trois résultats suivants des périodes de temps : d’octobre 1995 à décembre 2008 (1995-2008), de janvier 2009 à décembre 2016 (2009-2016), et de janvier 2017 à octobre 2018 (2017-2018).
Analyses statistiques
Les variables continues ont été décrites comme des moyennes ± standard déviation. Les variables catégorielles ont été décrites comme des pourcentages. Des analyses univoques ont été effectuées, en calculant les rapports de cotes non ajustés et en utilisant le chi carré ou le test exact de Fisher pour comparer les variables catégorielles, et le test t non apparié ou le test de Mann-Whitney-U pour les variables, le cas échéant. Une valeur de probabilité < 0,05 était considérée comme statistiquement significative. Les analyses statistiques ont été effectuée à l’aide du logiciel JMP (version 14.1.0 ; SAS Institute Inc, Cary, Caroline du Nord, États-Unis).
Résultats
Population
Au total, 71 patients (100 % de femmes, 47 ± 10 ans) ont été inclus. Les caractéristiques cliniques et d’imagerie sont détaillées dans le tableau 1. Un seul patient avait déjà subi un traitement de radiothérapie craniospinale pour un médulloblastome. Le nombre de patientes atteintes d’un méningiome associé à un progestatif et prises en charge dans notre établissement a augmenté au fil du temps : 0,5/an entre 1995 et 2007, 9,2/an entre 2008 et 2015, et 22,0/an entre 2016 et 2018 (Fig. 1).
Traitement au progestatif
Les caractéristiques du traitement aux progestatifs sont détaillées dans le tableau 1. L’acétate de cyprotérone a été administré dans 47/71 cas (66,2 %), l’acétate de chlormadinone dans 14/71 cas (19,7 %), l’acétate de nomégestrol dans 7 cas sur 71 (9,9%), et une combinaison de traitements progestatifs dans 3/71 cas (4,2 %). L’indication du traitement progestatif, disponible pour 37/71 patients (52,1 %), était une indication approuvée dans 10/37 cas (27,0%). La prévalence de la prescription de traitements non autorisés n’a pas changé au fil du temps (p = 0,240). La durée du traitement progestatif, disponible pour 23/71 patients (32,4%), était de 197 ± 71 mois. La dose cumulative de traitement progestatif, disponible pour 6/71 patients (8,5 %), était de 177,2 ± 89,1 grammes. Le temps : l’intervalle entre le début du traitement progestatif et le méningiome diagnostic, disponible pour 30/71 patients (42,3 %), était 202,0 ± 67,8 mois. L’intervalle de temps entre les méningiomes diagnostic et arrêt du traitement progestatif, disponible pour 41/71 patients (57,7 %), était de 8,4 ± 17,2 mois.
Caractéristiques du méningiome
Les caractéristiques des méningiomes sont détaillées dans le tableau 1. La raison pour l’imagerie par RM était un symptôme cliniquement apparent dans 54/71 (76,1%) cas et dépistage chez les patients asymptomatiques dans 17/71 cas (23,9%). 125 méningiomes ont été découverts, avec une moyenne de 1,7 ± 1,2 méningiomes par patient (fourchette 1-6) et 49 patients (69%) ayant un seul méningiome. La localisation la plus fréquente du méningiome était la convexité ou la région de la faux dans 60/125 cas (48%) et la région antérieure les régions de la base du crâne et de la fosse moyenne dans 54/125 cas (43,2%) (Fig. 2). La confirmation histopathologique, disponible pour les 36 cas qui ont été réséqués (28,8 % des méningiomes), a confirmé un méningiome dans tous les cas (22 étaient de grade OMS 1, 14 étaient des grades 2 de l’OMS). Le patient qui avait des antécédents de traitement de radiothérapie craniospinale a un méningiome de grade 2.
Note de l’association : l’OMS a changé ses critères donc il y a plus de grade 2 maintenant qu’avant, parce que l’OMS a révisé ses critères : elle a augmenté les critères faisant passer les méningiomes en grade 2, car elle veut alerter sur le fait que les méningiomes sont finalement moins bénins qu’on ne le pensait avant.
Le nombre de méningiomes n’a pas été associé de manière significative avec la durée du traitement progestatif (un méningiome : durée moyenne du traitement de 185 ± 72 mois, ≥ 2 méningiomes : durée moyenne du traitement de 216 ± 68 mois ; p = 0,358) ou avec le grade de malignité (grade 1 : moyenne de 195 ± 73 mois de traitement ; grade 2 : moyenne de 175 ± 64 mois de traitement ; p = 0,639).
En ce qui concerne le progestatif administré, une combinaison de dérivés de progestatifs a augmenté le nombre de méningiomes par patient (moyenne de 2,3 ± 0,6 méningiomes), par rapport au cyprotérone acétate (moyenne de 1,7 ± 1,2), acétate de nomégestrol (moyenne de 2,0 ± 1,8), et l’acétate de chlormadinone (moyenne de 1,6 ± 1,2, p = 0.050).
Gestion du progestatif
Suite au diagnostic de méningiome par IRM, la gestion de traitement progestatif était connue pour 68/71 patients (95.8%). Le progestatif a été retiré chez 55/68 patients (80,9 %) et a continué chez 13/68 patients (19,1 %). Il y a eu une augmentation de l’arrêt du traitement progestatif au fil du temps : 16,7% entre 1995 et 2008, 82,9% entre 2009 et 2016, et 95,2 % entre 2017 et 2018 (p < 0,001). Le site : le taux d’abandon du traitement varie en fonction du progestatif dérivé utilisé : l’acétate de cyprotérone a été retiré en 40/45 (88,9%), l’acétate de chlormadinone a été retiré en 11/13 (84,6 %), l’acétate de nomégestrol a été retiré en 2/7 (28,6 %), et la combinaison de dérivés de progestatifs a été retirée dans 2/3 (66.7% ; p = 0.002).
Gestion du méningiome
La gestion était inconnue pour trois méningiomes (2,4 %) chez deux patients (2,8 %). Une gestion conservatrice a été proposé pour 74 méningiomes (60,6 %) chez 36 patients (52.2%). Une prise en charge thérapeutique a été faite pour 47 méningiomes (39,3 %) chez 33 patients (47,8 %).
Les facteurs cliniques associés à la gestion thérapeutique étaient :
- la présence d’un déficit neurologique focal (50,0 % dans la gestion thérapeutique contre 11,4 % dans la gestion conservatrice, p < 0,001),
- une diminution du score KPS de ≥ 20 (85 % contre 95 %, p < 0,001)
- et des maux de tête (50,0 % contre 28,6 %, p = 0,072).
La résection chirurgicale de 36 méningiomes a été effectuée chez 28 patients, immédiatement après le diagnostic de méningiome chez 25 patients et après une moyenne de 16 ± 13,9 mois avec des suivis IRM chez trois patients.
La radiothérapie stéréotaxique de 11 méningiomes (trois clinoïdes antérieurs, trois convexes, deux à angle ponto-cérébelleux, un sinus caverneux et un méningiome cérébral de la faux ; neuf présentant une croissance progressive, deux symptomatiques) a été effectuée chez cinq patients.
Un traitement combiné (résection chirurgicale + stéréotaxie radiothérapie) a été effectuée pour un méningiome chez l’un de ces patients.
Aucun patient présentant un méningiome de grade 2 confirmé histopathologiquement n’a reçu de radiothérapie à la suite l’ablation chirurgicale.
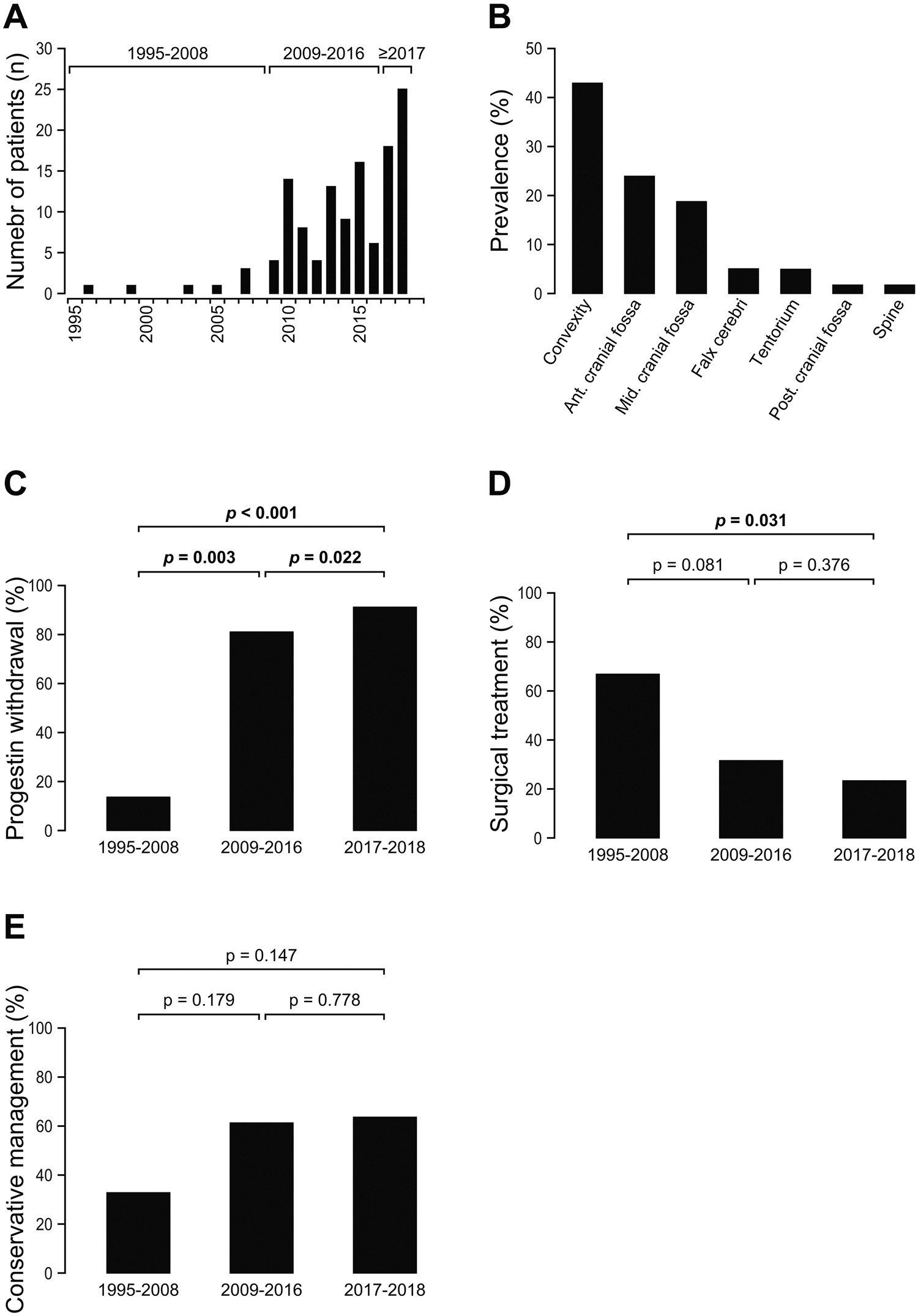
Fig. 1 a Nombre de patients par année (n) renvoyé à notre service de la neurochirurgie pour un ou plus de méningiomes suspects dans le cadre d’une politique à long terme l’utilisation de progestatifs entre 1995 et 2018. b Répartition des méningiomes localisation (%). c Évolution dans le temps de la proportion (%) de retrait de progestatif après le diagnostic d’un ou de plusieurs les méningiomes entre 1995 et 2018. d Évolution dans le temps de la proportion (%) de chirurgies le traitement d’un ou plusieurs méningiomes après leur diagnostic dans le cadre d’une politique à long terme l’utilisation de progestatifs entre 1995 et 2018. e Évolution dans le temps de la proportion (%) de conservateurs traitement d’un ou de plusieurs les méningiomes après leur diagnostic dans le cadre d’une politique à long terme l’utilisation de progestatifs entre 1995 et 2018.
Le taux de traitement des méningiomes a diminué (chirurgie et/ou radiothérapie) dans le temps : 66,7% entre 1995 et 2008, 46,3 % entre 2009 et 2016, et 35,7% entre 2017 et 2018 (< 0,001) ainsi qu’une augmentation de la gestion conservatrice des méningiomes avec un traitement progestatif suivi d’un sevrage plus de temps : 33,3% entre 1995 et 2008, 53,7% entre 2009 et 2016, et 64,3 % entre 2017 et 2018 (< 0,001). La prise en charge des méningiomes n’a pas varié en fonction du progestatif utilisé (p = 0,452).
Tableau 1 Données résumées sur les patients, les tumeurs, la gestion et le suivi
Caractéristiques du patient et de la tumeur au moment du diagnostic n % Sexe Masculin 0 0
Féminin 71 100
Âge (années) Moyenne ± SD (fourchette) 47,3 ± 9,6 (22-78)
Nombre de méningiomes par patient Moyenne ± SD (fourchette) 1,69 ± 1,24 (1-6)
Durée traitement par dérivé de progestatif (mois) Moyenne ± SD (fourchette) 197,2 ± 70,8 (60-312)
Dérivé de progestatif administré Acétate de cyprotérone 47 66.2
Acétate de chlormadinone 14 19.7
Acétate de nomégestrol 7 9.8
Combinaison 3 4.3
Symptômes Non 17 23,9
Oui 54 76,1
Déficit neurologique focal Non 51 71,8
Oui 20 28,2
Maux de tête Non 41 57,7
Oui 30 42,3
Crise d’épilepsie Non 56 78,9
Oui 15 21,1
Score KPS au moment du diagnostic Moyenne ± SD (fourchette) 88,5 ± 10,0 (60-100)
70 et plus 70 98,6
< 70 1 1.4
Localisation du méningiome Convexité 54 43.2
Falcine et parafalcine 6 5.6 Fosse antérieure ou moyenne 54 43,2
Cérébelleux (tentorium) 7 5,6
Région de Falx et parafalcine 6 4,8
Colonne vertébrale 2 1.6
Angle ponto-cérébelleux 1 0.8
Angle ponto-cérébelleux 1 0,8
Foramen magnum 1 0,8
Données de gestion et de suivi n
Retrait de progestatif Non 13 18.3
Oui 55 77,5
Non disponible 3 4,2
Gestion du méningiome Conservateur 36 50,7
Traitement 32 45,1
Non disponible 3 4.2
Traitement du méningiome Chirurgie 28 39,4
Radiothérapie stéréo… 5 7.0
Chirurgie/radiothérapie stéréo… 1 1.4
Complications postopératoires de l’opération Déficit neurologique transitoire 7 25,9
Ischémie 3 11,1
Infection 3 11,1
Crises d’épilepsie 2 7,4
Ampleur de la résection (grade Simpson) I 7 19.4
II 23 63.9
III-IV 6 16.7
OMS Grade de malignité I 22 61,1
II 14 38.9
Durée du suivi postopératoire (mois) Moyenne ± SD (fourchette) 38,3 ± 34,4 (3-216)
Série complète 45.8 ± 41.7 (3–216)
Méningiomes traités 33.1 ± 27.3 (3–93)
Les méningiomes gérés de manière conservatrice
Score du KPS lors du dernier suivi Moyenne ± SD (fourchette) 94,6 ± 9,1 (50-100)
70 et plus 49 98,0
< 70 1 2.0
Suivi radiographique des méningiomes gérés de manière conservatrice
(n = 59) Augmentation du volume 3 5.1
Un volume stable 40 67.8
Diminution du volume 16 27.1
Suivi radiographique des méningiomes traités (n = 41) Récidive 3 7.3
Pas de récurrence 34 82.9
Résidu stable 4 9.8
Suivi clinique et d’imagerie
Les données de suivi clinique et d’imagerie sont illustrées dans Fig. 2. Calendrier des dernières campagnes d’imagerie postopératoire et de suivi pour l’ensemble de la série, disponible pour 100/125 méningiomes (80,0%), était de 38,3 ± 34,4 mois. Pour les 47 méningiomes traités, la durée moyenne des dernières l’imagerie postopératoire et le suivi clinique, disponible pour 41/47 méningiomes (87,2%), était de 45,8 ± 41,7 mois.
Parmi les 31 méningiomes traités par chirurgie avec un postopératoire suivi disponible, il y a eu :
- 2 récidives (6,5%),
- stable résiduel dans 1 (3,2%),
- et aucune récurrence dans 28 méningiomes (90.3%).
Sur les 10 méningiomes traités par radiothérapie avec un suivi postopératoire disponible, il y avait :
- une maladie progression en 1 (10,0 %),
- résidu stable en 3 (30,0 %),
- et régression dans 6 méningiomes (60,0%).
Il y a eu plus de régressions de méningiomes après radiothérapie chez les patients sous acétate de cyprotérone (85,7 %) que chez les patients sous dérivé de progestatif (0 %, p < 0,001). La gestion de la l’agoniste progestatif est connu pour les méningiomes traités à 40/41 avec un suivi connu (97,6 %).
Parmi les 27 méningiomes traités pour laquelle le progestatif avait été retiré :
- 1 (3,7 %) ont montré une progression de la maladie,
- 3 (11,1 %) ont montré
- et 23 (85,2 %) ont montré une régression de la tumeur.
Parmi les 13 méningiomes traités pour lesquels le progestatif avait été poursuivie :
- la progression de la maladie a été observée dans 2 (15,4%)
- et une régression tumorale constatée dans 11 méningiomes (84,6 %) après un traitement progestatif.
Pour les 74 méningiomes gérés de manière conservatrice, le calendrier moyen des derniers examens d’imagerie postopératoire et des suivi, disponible pour 59/74 méningiomes (79,7%), était 33,1 ± 27,3 mois :
- Trois méningiomes (5%) ont démontré une croissance de la tumeur,
- 40 méningiomes (68%) une stabilité de la croissance,
- et 16 méningiomes (27%) une régression tumorale.
Il n’y a pas eu de différences significatives dans la croissance des tumeurs en fonction du progestatif molécule utilisée (p = 0,230). La gestion du progestatif agoniste est connu pour 57/59 méningiomes gérés de manière conservatrice, avec un suivi connu (96,6 %).
Parmi les 54 méningiomes gérés de manière conservatrice pour lesquels le progestatif avait été retiré :
- la croissance de la tumeur était présente dans 1 cas (1,9%),
- stabilité de la croissance dans 37 cas (68,5%)
- et régression de la tumeur dans 16 cas (29,6 %).
Les trois méningiomes dont le progestatif avait été poursuivi ont démontré la présence d’une tumeur croissance dans le temps (100%).
Discussion
Principaux résultats
Nous montrons, dans une série monocentrique et rétrospective de 125 méningiomes associés à un progestatif chez 71 femmes adultes, que :
(1) le nombre de patients atteints de méningiome associé à un progestatif géré dans notre service de neurochirurgie a augmenté dans le temps ;
(2) la raison du traitement progestatif était un traitement avec une indication validée dans un quart des cas ;
(3) une combinaison de progestatifs augmente considérablement le nombre de méningiomes par patient par rapport à un progestatif unique ;
(4) il y a eu une augmentation au fil du temps de la gestion des méningiomes ainsi qu’une augmentation au fil du temps de l’arrêt du traitement progestatif ;
(5) l’arrêt du traitement progestatif varie en fonction du dérivé progestatif utilisé ;
et (6) après le retrait du traitement progestatif, les méningiomes associés aux progestatifs gérés de manière conservatrice ont présenté une régression sur l’imagerie de suivi dans 30 % des cas.
Interprétation
Les méningiomes associés à un progestatif partagent la même imagerie et les résultats histopathologiques que ceux de l’enquête générale d’une population.
Les données actuelles confirment le niveau 2 atypique.
Les méningiomes peuvent être observés dans le cadre de l’utilisation de progestatifs, comme indiqué précédemment [22], et comme observé dans la population générale.
Le nombre de méningiomes par patiente ne différait pas en fonction du dérivé progestatif utilisé, sauf avec une combinaison de progestatifs qui était associée avec un nombre accru de méningiomes. Bien que cette observation soit limitée à trois patients, ce qui nécessite des études sur le sujet, il suggère d’être prudent en ce qui concerne les indications de démarrage d’un deuxième agoniste du progestatif dans les patients qui en reçoivent déjà un.
Le petit nombre de patients pour laquelle la durée du traitement progestatif était connue dans notre étude (32,4 %) a empêché d’enquêter sur l’association entre la durée/dose du traitement progestatif et la nombre de méningiomes [6, 23].
Ici, la régression réelle du méningiome après l’interruption du progestatif, observée dans 30 % des cas au cours d’une suivi par imagerie à > 33 mois, contraste avec les rapports. Une série de cas analysant l’effet de l’utilisation de progestatifs sur la croissance des méningiomes a fait état d’un taux plus élevé (> 90%) de régression du méningiome après le retrait de du progestatif [17, 18, 21]. Une étude de cohorte, axée sur l’utilisation de l’acétate de cyprotérone en France [23], a démontré une régression tumorale dans 50% des lésions après le retrait de l’acétate de cyprotérone. Cette observation exige des analyses quantitatives multicentriques et aveugles sur suivi d’imagerie à long terme. La présente étude sur les centres uniques démontre une augmentation dans les méningiomes associés à un progestatif, renvoyés à la neurochirurgie et un changement dans la gestion thérapeutique des méningiomes et du progestatif au fil du temps (augmentation du progestatif, diminution du traitement chirurgical de méningiomes, et augmentation de la gestion conservatrice de méningiomes).
L’utilisation généralisée de progestatif en France depuis les années 80, y compris l’utilisation hors indication, peut expliquer l’augmentation du nombre de méningiomes associés aux progestatifs par l’exposition cumulative au progestatif au fil du temps. En outre, l’augmentation du nombre de méningiomes associés aux progestatifs au fil du temps peut être lié aux progrès de la médecine et à l’augmentation les connaissances relatives à cette condition spécifique. Les prescripteurs de progestatifs semblent être plus conscients du risque que représente les méningiomes à progestatif grâce à l’augmentation du nombre de publications concernant la relation entre le progestatif et la croissance des méningiomes depuis 2008 [3-10, 14, 18] illustrée par une augmentation des diagnostics de méningiome par le dépistage par IRM au fil du temps.
La nouvelle politique de dépistage par imagerie proposé pour tous les patients recevant des dérivés de progestatifs, mis en œuvre en France en octobre 2018 [24, 25], fera probablement augmenter le nombre de méningiomes associés aux progestatifs dans les années à venir. En outre, nous avons observé que 73% des patients ont reçu un progestatif sans indication approuvée. En France, les recommandations de l’Agence nationale du médicament et de la sécurité sanitaire des produits de santé soulignent la nécessité de vérifier la bonne utilisation et d’évaluer le rapport bénéfice/risque pour chaque prescription d’acétate de cyprotérone [24]. Cet effort contribuera probablement à réduire le nombre de méningiomes associés à l’acétate de cyprotérone à l’avenir.
Il convient de noter que le changement observé dans la gestion des progestatifs a varié dans le temps en fonction de l’agoniste du progestatif : l’acétate de cyprotérone a été plus souvent retiré et l’acétate de nomégestrol a été moins souvent retiré que d’autres dérivés du progestatif. Les prescripteurs doivent être conseillés concernant les effets secondaires de chaque progestatif et l’utilité de son retrait dans le cas de méningiomes, en gardant à l’esprit les effets nocifs potentiels d’un arrêt brutal dans les maladies hormonales.
Dans la présente série, la décision de traitement fondée sur la présence de signes cliniques ou de déficits neurologiques est diminué dans le score KPS, qui était plus souvent chirurgical et les patients aux diagnostics fortuits de méningiome étaient plus souvent traités avec une gestion conservatrice.
Nous avons souligné que 38,4 % des méningiomes associés à un progestatif et 46,5 % des patients ont été traités chirurgicalement, ce qui suggère que ces méningiomes n’ont pas systématiquement un parcours indolent et ces les patients sont exposés à des risques de complications postopératoires liées à l’opération. La faisabilité d’une gestion conservatrice, quel que soit le dérivé progestatif utilisé, en l’absence de handicap neurologique, est confirmée par les données actuelles.
Pour en savoir plus : des études évalueront l’impact d’une gestion conservatrice pour les méningiomes associés à un progestatif et présentant des déficiences. En outre, la pertinence de la prise en charge d’un ostéoméningiome associé à un progestatif, où la régression de la composante osseuse de la tumeur est peu probable après l’arrêt de progestatif, reste à traiter. Ces observations devraient aider à conseiller les femmes qui viennent d’avoir des méningiomes diagnostiqués qui sont sous traitement progestatif que, bien que ces tumeurs puissent progresser, la nécessité d’une intervention chirurgicale est rare.
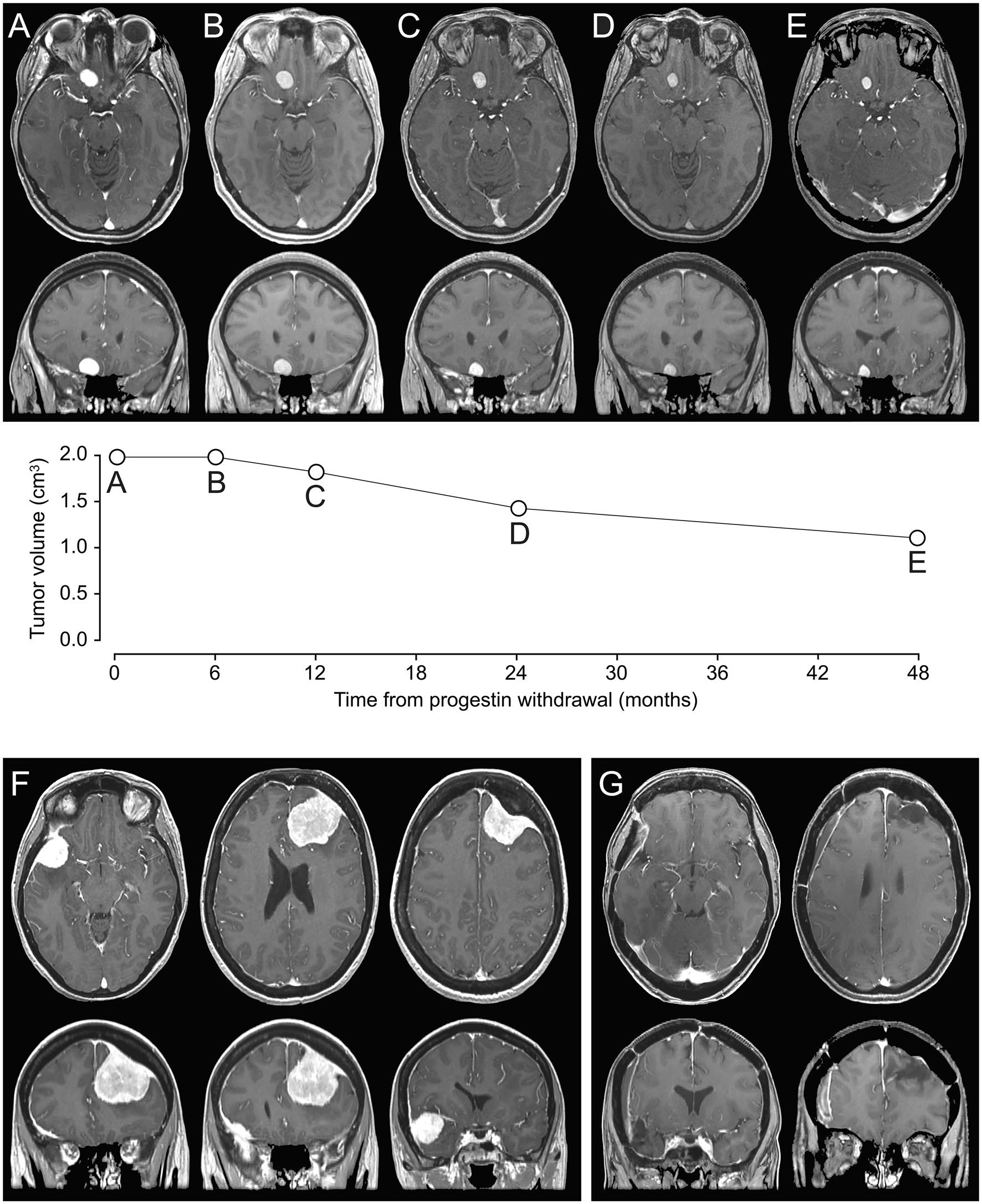
Fig. 2 a-e Une femme de 34 ans ayant des antécédents d’acné traitée avec acétate de cyprotérone pendant 9 ans. Après le diagnostic d’une suspicion de méningiome fronto-basal droit sur une première IRM réalisée pour des maux de tête, une gestion conservatrice avec retrait du progestatif a été poursuivie. L’évaluation quantitative des IRM de suivi séquentiel (A, IRM initiale ; B, IRM postopératoire à 6 mois ; C, postopératoire à 1 an IRM ; D, IRM 2 ans après l’opération ; E, IRM 4 ans après l’opération) a démontré la régression du méningiome suspecté.f-g A Une femme de 49 ans ayant des antécédents de fibromes utérins traitée au nomégestrol acétate, suivi de l’acétate de chlormadinone pendant 10 ans. Un méningiome frontal gauche et un ostéomeningiome sphéno-orbitaire droit ont été diagnostiqués à la suite d’une première crise d’épilepsie. Le progestatif a été retirée et les deux méningiomes ont été réséqués séparément à 6 mois l’intervalle. Les analyses histopathologiques ont confirmé deux méningiomes de grade 2. Après l’opération, il n’y a pas eu de récidive des crises d’épilepsie et la thérapie antiépileptique a été interrompue six mois après la deuxième chirurgie (F : IRM préopératoire, G : IRM 3 ans après l’opération).
Limitations
Ces résultats doivent être interprétés avec prudence, compte tenu de la conception exploratoire et rétrospective de l’étude, ainsi que des données manquantes. Nous reconnaissons les biais induits par l’inclusion de chaque lésion durale découverte à l’IRM avec les caractéristiques d’imagerie d’un méningiome, qui ont ensuite été appelé « méningiome ». Cependant, toutes les lésions durales opérées ont été confirmées comme des méningiomes par des analyses histopathologique. Nous reconnaissons les biais induits par les patients qui s’adressent eux-mêmes à la neurochirurgie. Il est possible que des méningiomes petits et asymptomatiques, gérés par des médecins généralistes, des gynécologues ou des endocrinologues, n’aient pas été saisis. Cela pourrait expliquer le taux élevé de méningiomes symptomatiques et traités chirurgicalement dans la présente étude. En outre, le suivi relativement court en dessous de la norme communément utilisée de 5 ans et le manque de données concernant la durée du traitement progestatif et la dose cumulée de progestatif a empêché des analyses détaillées de l’impact réel du progestatif sur l’évolution des méningiomes, y compris le nombre de méningiomes. La question de l’impact des stratégies de gestion conservatrice des méningiomes associés à une déficience neurologique n’a pas encore trouvé de réponse puisque nous n’avons pas de méningiomes associés à une déficience neurologique dans le groupe de gestion conservatrice. Cependant, des rapports précédents ont suggéré l’efficacité de la gestion conservatrice dans de tels cas [19]. Enfin, nous n’avons pas effectué un examen neuropathologique central en aveugle pour évaluer le degré de malignité des méningiomes selon la classification actuelle de l’OMS 2016 et il nous manque une recherche de l’immuno-expression des récepteurs de progestérone et d’œstrogène. Les changements dans le classement histopathologique des méningiomes selon les différentes versions de la classification de l’OMS de 2000 à 2016 [26-28] peuvent expliquer les taux de méningiomes atypiques de grade 2.
Par conséquent, la prise en charge pratique des méningiomes associés à un progestatif reste à confirmer par des enquêtes multicentriques prospectives ultérieures avec des évaluations quantitatives des modifications des méningiomes pendant le traitement au progestatif et après l’arrêt du traitement.
Généralisation des résultats
La présente étude, avec un manque d’informations détaillées concernant l’utilisation de progestatifs, souligne la nécessité de normaliser davantage la collecte de données sur les informations essentielles concernant les traitements progestatifs. Une telle collecte de données prospectives a été a débuté dans notre institution depuis octobre 2018 pour tous les patients qui ont reçu des dérivés de progestatifs. En outre, nous avons maintenant proposer un accès ciblé et facile à l’IRM pour les patients sous un traitement progestatif pour faciliter le dépistage conformément à les récentes recommandations de l’ANSM [24]. Ces futures données permettront d’améliorer nos connaissances sur l’histoire naturelle de les méningiomes associés aux progestatifs et leur gestion.
Conclusion
Dans une série monocentrique de 125 méningiomes associés à un progestatif chez 71 femmes adultes recueillies entre 1995 et 2018, le nombre de patients atteints de méningiome associé à un progestatif a augmenté au fil du temps. La prise en charge conservatrice, y compris l’arrêt du traitement progestatif, s’est développée au fil du temps avec des résultats prometteurs en termes d’efficacité et de sécurité.
Author contributions HM, TS, JB, and JP did the data collection. HM, TS, MZ, AR, JB, and JP did the data analysis. HM, TS, MZ, AR, JB, GZB, ME, ATE, ED, EP, FC, PV, GPB, CO, and JP did the data interpretation.
HM, JB, SP, and JP wrote the report. HM, TS, MZ, AR, JB, GZB, ME, ATE, ED, EP, FC, PV, GPB, CO, SP, and JP reviewed and approved the paper.
Data availability Anonymized data will be shared per request from any qualified investigator.
Compliance with ethical standards
Conflict of interest The authors declares that they have no conflict of interest to disclose.
Consent to participate The requirement to obtain informed consent was waived for this observational retrospective study according to French legislation.
Consent for publication All co-authors have seen and agree with the contents of the manuscript.
Ethical approval This study received required authorizations (IRB #1: 2020/08) of the institutional review board (IRB00011687). The requirement to obtain informed consent was waived for this observational
retrospective study according to French legislation.
References
1. Ostrom QT, Gittleman H, Truitt G et al (2018) CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2011–2015. Neuro-Oncol 20:iv1–iv86. https://doi.org/10.1093/neuon c/noy13 1
2. Wiemels J, Wrensch M, Claus EB (2010) Epidemiology and etiology of meningioma. J Neurooncol 99:307–314. https ://doi.org/10.1007/s1106 0-010-0386-3
3. Sys C, Kestelyn P (2015) Unilateral proptosis and blindness caused by meningioma in a patient treated with cyproterone acetate. GMS Ophthalmol Cases 5:2193–1496. https ://doi.org/10.3205/oc000 027
4. Nota NM, Wiepjes CM, de Blok CJM et al (2018) The occurrence of benign brain tumours in transgender individuals during cross-sex hormone treatment. Brain 141:2047–2054. https ://doi.org/10.1093/brain /awy10 8
5. Bergoglio MT, Gómez-Balaguer M, Almonacid Folch E et al (2013) Symptomatic meningioma induced by cross-sex hormone treatment in a male-to-female transsexual. Endocrinol Nutr 60:264–267. https://doi.org/10.1016/j.endon u.2012.07.004
6. Gil M, Oliva B, Timoner J et al (2011) Risk of meningioma among users of high doses of cyproterone acetate as compared with the general population: evidence from a population-based cohort
study: risk of meningioma among users of high doses of cyproterone acetate. Br J Clin Pharmacol 72:965–968. https ://doi.org/10.1111/j.1365-2125.2011.04031 .x
7. Mancini I, Rotilio A, Coati I et al (2018) Presentation of a meningioma in a transwoman after nine years of cyproterone acetate and estradiol intake: case report and literature review. Gynecol Endocrinol
34:456–459. https ://doi.org/10.1080/09513 590.2017.1395839
8. Alderman CP (2016) Probable drug-related meningioma detected during the course of medication review services. Consult Pharm 31:500–504. https ://doi.org/10.4140/TCP.n.2016.500
9. Cea-Soriano L, Blenk T, Wallander M-A, Rodríguez LAG (2012) Hormonal therapies and meningioma: is there a link? Cancer Epidemiol 36:198–205. https ://doi.org/10.1016/j.canep .2011.08.003
10. Schmutz J-L (2018) Cyproterone acetate and meningioma: the latest findings. Ann Dermatol Venereol 145:390–391. https ://doi.org/10.1016/j.annde r.2018.04.001
11. Neumann F, Töpert M (1986) Pharmacology of antiandrogens. J Steroid Biochem 25:885–895. https ://doi.org/10.1016/0022-4731(86)90320 -1
12. Druckmann R (2009) Profile of the progesterone derivative chlormadinone acetate—pharmocodynamic properties and therapeutic applications. Contraception 79:272–281. https ://doi.org/10.1016/j.contraception.2008.10.017
13. Mueck AO, Sitruk-Ware R (2011) Nomegestrol acetate, a novel progestogen for oral contraception. Steroids 76:531–539. http://doi.org/10.1016/j.steroids.2011.02.002
14. Gazzeri R, Galarza M, Gazzeri G (2007) Growth of a meningioma in a transsexual patient after estrogen–progestin therapy. N Engl J Med 357:2411–2412. https ://doi.org/10.1056/NEJMc 07193 8
15. Shimizu J, Matsumoto M, Yamazaki E, Yasue M (2008) Spontaneous regression of an asymptomatic meningioma associated with discontinuation of progesterone agonist administration. Neurol Med Chir (Tokyo) 48:227–230. https ://doi.org/10.2176/nmc.48.227
16. Gonçalves AMG, Page P, Domigo V et al (2010) Abrupt regression of a meningioma after discontinuation of cyproterone treatment: fig. 1. Am J Neuroradiol 31:1504–1505. https ://doi.org/10.3174/ajnr.A1978
17. Cebula H, Pham TQ, Boyer P, Froelich S (2010) Regression of meningiomas after discontinuation of cyproterone acetate in a transsexual patient. Acta Neurochir (Wien) 152:1955–1956. https://doi.org/10.1007/s0070 1-010-0787-2
18. Bernat AL, Oyama K, Hamdi S et al (2015) Growth stabilization and regression of meningiomas after discontinuation of cyproterone acetate: a case series of 12 patients. Acta Neurochir (Wien) 157:1741–1746. https ://doi.org/10.1007/s0070 1-015-2532-3
19. Bernat A, Bonnin S, Labidi M et al (2018) Regression of giant olfactory groove meningioma and complete visual acuity recovery after discontinuation of cyproterone acetate. J Ophthalmic Vis Res
13:355. https ://doi.org/10.4103/jovr.jovr_21_17
20. Botella C, Coll G, Lemaire J-J, Irthum B (2015) Méningiomes intracrâniens et utilisation prolongée d’acétate de cyprotérone à dose conventionnelle chez la femme: à propos de deux cas de régression tumorale après arrêt du traitement. Neurochirurgie 61:339–342. https ://doi.org/10.1016/j.neuch i.2015.05.002
21. Passeri T, Champagne P-O, Bernat A-L et al (2019) Spontaneous regression of meningiomas after interruption of nomegestrol acetate: a series of three patients. Acta Neurochir (Wien) 161:761–
765. https ://doi.org/10.1007/s0070 1-019-03848 -x
22. Roux A, Tauziede-Espariat A, Zanello M et al (2020) Symptomatic progestin-induced atypical grade II meningioma. A first case report. Neurochirurgie. https ://doi.org/10.1016/j.neuchi.2019.12.013
23. Acétate de cyprotérone (Androcur et ses génériques) et risque de méningiome: publication du rapport complet de l’étude de pharmaco-épidémiologie—Point d’information—ANSM : Agence nationale de sécurité du médicament et des produits de santé. https://ansm.sante .fr/S-informer/Point s-d-information-Point s-d-information/Acetate-de-cyproterone-Androcur-et-ses-generiques-etrisque-de-meningiome -publication-du-rapport-complet-de-l-etude-de-pharmaco-epidemiologie-Point -d-information. Accessed 10 May 2020
24. Androcur et génériques (acétate de cyprotérone, 50 mg et 100 mg) et risque de méningiome: l’ANSM publie des recommandations pour la prise en charge des patients—Point d’information—ANSM : Agence nationale de sécurité du médicament et des produits de santé. https ://ansm.sante .fr/S-infor mer/Point s-d-information-Point s-d-information/Andro cur-et-generiques -acetate-de-cypro teron e-50-mg-et-100-mg-et-risqu e-de-menin giome-l-ANSM-publi e-des-recom manda tions -pour-la-prise -en-charg
e-des-patie nts-Point -d-infor matio n. Accessed 9 May 2020
25. Lutényl/Lutéran et génériques: recommandations préliminaires suite à la confirmation du sur-risque de méningiome—Point d’Information—ANSM : Agence nationale de sécurité du médicament
et des produits de santé. https ://www.ansm.sante .fr/S-informer/Point s-d-infor matio n-Point s-d-information/Lutenyl-Luteran-et-generiques -recommandations -preliminaires-suite -a-laconfirmation-du-sur-risque-de-meningiome -Point -d-Information. Accessed 18 Nov 2020
26. Kleihues P, Cavenee WK, International Agency for Research on Cancer (2000) Pathology and genetics of tumours of the nervous system. IARC Press, Lyon
27. Louis DN, Ohgaki H, Wiestler OD et al (2007) The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol (Berl) 114:97–109. https ://doi.org/10.1007/s00401-007-0243-4
28. Louis DN, Perry A, Reifenberger G et al (2016) The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathol (Berl) 131:803–820. https://doi.org/10.1007/s0040 1-016-1545-1
Publisher’s note Springer Nature remains neutral with regard to
jurisdictional claims in published maps and institutional affiliations.
Note de l’association AMAVEA sur cette étude :
Cette étude portant sur 125 méningiomes chez 71 femmes sur 23 ans, dans un hôpital, là l’hopital Sainte-Anne du GHU PARIS est primordiale pour mettre à jour et comprendre plusieurs facteurs qui interrogent :
- Augmentation du nombre de cas au fil du temps
- Moins de 30% d’indications validées pour les traitements (traitement s hormonaux prescrits hoars AMM dans 70 % des cas)
- Augmentation de l’arrêt des traitements après diagnostic de méningiome au fil du temps (les médecins apprennent tout de même)
- Augmentation de l’attitude de simple surveillance au fil du temps.
- Sur le suivi IRM, diminution des méningiomes après arrêt dans 30% des cas, stabilité dans 68% et poursuite de la croissance dans 2% des cas (on est loin des 60% de diminution rapportés par Lariboisière).
- Nécessité de traitement (chirurgie, radiothérapie) chez 47% des patientes (avec les risques et les séquelles de la chirurgie). On est loin très loin du terme « bénin » employé constamment pour ces méningiomes par les gynécologues princpalement et par la presse !
- effets à long terme inconnus
- responsabilisation des médecin nécessaire, sanctions contre les médecins qui prescrivent hors AMM en mettant en jeu la vie des patientes ?
Etude reprise ici par NEURODIEM : https://www.neurodiem.fr/news/progestin-associated-meningiomas-can-be-managed-by-discontinuing-treatment-6g0t3ALMzkTLkNPkkA0xoa?utm_medium=newsletter&utm_source=neurodiem&utm_campaign=ND_FR_NL_Weekly_04_02_2021&utm_content=css%7C3%7C7
Lien sur PUBMED https://pubmed.ncbi.nlm.nih.gov/33449307/
Retrouvez nos autres articles ici




