Épilepsie liée au méningiome – physiopathologie, prédicteurs et traitement de crises pré/postopératoires
par Rasha Elbadry Ahmed1†, Hailiang Tang2†, Anthony Asemota1, Lei Huang1,3, Warren Boling1*‡ et Firas Bannout4*‡
– 1Département de neurochirurgie, Centre médical universitaire de Loma Linda, Loma Linda, CA, États-Unis
– 2Département de neurochirurgie, Hôpital Huasha, Université Fudan, Shanghai, Chine
– 3Département de physiologie et de pharmacologie, Université de Loma Linda, Loma Linda, CA, États-Unis
– 4Département de neurologie, Centre médical de l’Université de Loma Linda, Loma Linda, CA, États-Unis
Les méningiomes sont les tumeurs cérébrales primaires les plus courantes et représentent environ 30 % de toutes les tumeurs cérébrales. La grande majorité des méningiomes ont une croissance lente et une histopathologie bénigne, ce qui les rend curables par la seule chirurgie.
Les lésions symptomatiques dépendent de leur localisation avec des signes d’effet de masse ou des déficits neurologiques.
Les crises d’épilepsie sont le symptôme principal dans environ 30 % des cas, ce qui affecte négativement la qualité de vie, limite l’indépendance, altère le fonctionnement cognitif et augmente le risque de comorbidités psychiatriques, notamment la dépression.
Bien que la résection chirurgicale puisse offrir une absence de crises dans 60 à 90 % des méningiomes, les crises persistent après la résection chirurgicale chez environ 12 à 19 % des patients.
Les médicaments anti-convulsions (ASM) sont utilisés dans la prise en charge, mais ils sont limités par des effets secondaires neurocognitifs indésirables et par leur inefficacité chez certains patients.
Les prédicteurs potentiels des crises pré et postopératoires chez les patients atteints de méningiome ont été identifiés dans la littérature.
La compréhension des différents facteurs associés à la probabilité de crises chez les patients atteints de méningiome peut aider à guider un contrôle plus efficace des crises et permettre une meilleure détermination du risque avant et après la chirurgie.
Introduction
Les méningiomes représentent environ 30 % des tumeurs cérébrales primaires et approximativement 54% des tumeurs bénignes primaires (1-3). La grande majorité des méningiomes sont d’évolution lente et d’histopathologie bénigne (c’est-à-dire des tumeurs de grade I de l’Organisation mondiale de la santé (OMS)), ce qui les rend curables par la seule chirurgie (4, 5). Les lésions symptomatiques dépendent de leur localisation avec des signes d’effet de masse ou des déficits neurologiques. Les crises d’épilepsie sont le symptôme initial dans environ 30 % des cas, et dans certaines études, le pourcentage varie de 13 à 60 % (6-8). Bien que la résection chirurgicale puisse offrir une absence de crises dans 60-90 % des méningiomes, les crises peuvent persister après la résection chirurgicale chez environ 12-19 % des patients (9, 10). Les crises peuvent avoir un impact négatif sur la qualité de vie, en entravant l’indépendance du patient, ses fonctions cognitives et sa capacité à conduire en toute sécurité (11-13). Elles exposent les patients à un risque accru de différentes comorbidités psychiatriques, dont la dépression (14). Le contrôle des crises à l’aide de divers médicaments anti-crises (ASM) est généralement proposé malgré les effets secondaires indésirables sur la neurocognition et l’inefficacité chez certains patients (15).
De nombreuses théories ont été avancées pour expliquer la pathogenèse de l’épilepsie liée aux tumeurs cérébrales (BTRE) dans diverses tumeurs cérébrales ; cependant, des questions restent sans réponse concernant le contrôle et la gestion des crises chez les patients atteints de méningiomes, par exemple, la capacité des résections chirurgicales à guérir les crises, quand commencer les ASM, la durée du traitement ainsi que des directives structurées pour la sélection des patients pour les ASM. Comprendre et prédire les crises dans les méningiomes peut aider à guider le contrôle des crises et permettre de mieux déterminer les patients à risque avant et après la chirurgie. Cette revue a pour but de résumer la pathogenèse des crises dans les méningiomes, les facteurs prédictifs pré et postopératoires des crises, la résection chirurgicale qui permet d’éliminer les crises, les avantages de l’utilisation des ASM, l’électrocorticographie (ECoG) peropératoire et la surveillance de l’électroencéphalogramme (EEG) chez les patients atteints de méningiomes et la sélection adéquate des patients.
Incidence de l’épilepsie dans les méningiomes
L’incidence des crises préopératoires dans le cas des méningiomes a été rapportée respectivement à 29 % sur 4709 patients (7) et à 14 % sur 598 patients (16) atteints de méningiomes supratentoriels.
L’absence de crises a été obtenue chez environ 69 % des patients après la chirurgie, avec 12 % de nouvelles crises survenant après la chirurgie (17). L’étude de Chozick a rapporté que 63/158 patients atteints de méningiome avaient des crises préopératoires et que 40 (63,5 %) des 63 patients avaient une résolution complète des crises après la chirurgie dans les années de suivi de 7,3± 3,8. Dans cette cohorte, 100 % des 63 patients étaient sous traitement anticonvulsivant avant l’opération et pendant la phase initiale postopératoire. Les auteurs n’ont pas indiqué la proportion exacte de ces 43 patients sevrés de médicaments anticonvulsivants au fil du temps postopératoire. Alors que certains neurochirurgiens avaient tendance à cesser d’utiliser les médicaments environ 6 mois après l’opération s’il n’y avait aucun signe de crises, les autres neurochirurgiens ont continué à utiliser les anticonvulsivants à titre prophylactique. Ils ont rapporté que quatre-vingt-cinq patients (53,8 % des 158) ont finalement été sevrés d’anticonvulsivants et que 44,7 % d’entre eux n’avaient pas cessé d’en prendre lors de la dernière visite de suivi postopératoire. Les crises sont réapparues chez un patient pendant le processus de sevrage des ASM, chez 4 patients avec des niveaux d’ASM sous-thérapeutiques, chez 6 patients qui n’étaient pas sous ASM, chez 2 patients corrélés à l’abus d’alcool et chez 5 patients avec une récidive tumorale. Huit patients (5,1%) sans antécédents d’épilepsie préopératoire ont développé des crises postopératoires. Chozick et al. ont conclu que dans leur étude, seule l’étendue de l’ablation de la tumeur était un facteur prédictif significatif de crises postopératoires.
Cependant, des antécédents de crises épileptiques préopératoires, des troubles du langage préopératoires, le statut postopératoire des médicaments anti-crises, l’hydrocéphalie postopératoire ou la localisation de la tumeur dans la région pariétale étaient également des facteurs prédictifs de la survenue de crises épileptiques postopératoires (18). Wirsching a rapporté 26,6 % de crises postopératoires au cours d’une période médiane de 67 mois (IC 95 % : 63-72) de suivi postopératoire (19).
La grande variation de ces études peut être due au manque de standardisation des données recueillies rétrospectivement chez des patients ayant des caractéristiques démographiques différentes, des caractéristiques/localisations/types de méningiomes différents, des périodes de suivi différentes, des analyses de groupes d’âge différentes entre les patients pédiatriques et adultes, et des compétences et techniques chirurgicales différentes dans des institutions différentes. La majorité des crises postopératoires ont été ressenties au cours de la première semaine après l’opération, mais un tiers des patients ont présenté des crises trois mois après l’opération (17).
Pathogénie de l’épilepsie liée au méningiome
La pathophysiologie de l’épilepsie liée à une tumeur cérébrale est multifactorielle et peut être divisée en causes morphologiques, biochimiques et métaboliques.
Les changements morphologiques dans le néocortex péritumoral comprennent la connexion des neurones et la connectivité et la localisation des vésicules synaptiques, entraînant une concentration plus élevée des canaux Na+ dépendants du voltage, du Ca++ et des récepteurs du glutamate avec une perte des synapses inhibitrices et une augmentation des synapses excitatrices. Sur le plan biochimique, on observe une augmentation des neurones glutamatergiques et une réduction des neurones GABAergiques immunoréactifs à la somatostatine. Au niveau ionique, on observe un faible taux de Mg2+, un taux élevé de K+ extracellulaire, un taux élevé de Fe3+, un faible taux de K+/Cl- cotransporter-2 (KCC2) spécifique aux neurones. On pense que le pH extracellulaire péritumoral est légèrement alcalin. Enfin, il y a des changements enzymatiques, d’acides aminés et immunologiques avec une régulation à la hausse des récepteurs glutamatergiques pour les neurotransmetteurs NMDA et AMPA (24).
Plus récemment, les facteurs génétiques de l’épileptogénicité des méningiomes ont été étudiés. La mutation NF2 s’est avérée être un marqueur prédictif de crises préopératoires, via un effet de médiation indirect avec l’histologie atypique et l’œdème (25). Le méningiome provient des cellules de la calotte arachnoïde et est généralement une tumeur à croissance lente (1). Cette croissance lente peut expliquer en partie les modifications péritumorales qui conduisent à l’épileptogénicité (24, 26). La différenciation partielle de la surface corticale du cerveau peut produire une zone épileptogène, provoquant ainsi une hypersensibilité de dénervation (27). Les changements morphologiques qui se développent dans le tissu cérébral adjacent à la lésion, comme la migration neuronale inefficace, les vésicules synaptiques et les altérations du couplage gap-jonction glial, sont également censés contribuer à la génération de crises (28). Bien que les méningiomes pédiatriques soient rares, l’épilepsie a été signalée comme l’un des symptômes courants (29). Une migration neuronale inefficace pourrait constituer un mécanisme péritumoral supplémentaire d’épileptogenèse dans ce groupe d’âge de patients.
Le pourcentage d’œdème cérébral chez les patients atteints de méningiome varie entre 30 et 60 % (30-32). Il est généralement vasogénique et lié à une augmentation de l’apport pial, à l’angiogenèse et à l’expression accrue du facteur de croissance endothélial vasculaire (VEGF) (33, 34). Les modifications chimiques du milieu péritumoral et l’hypoxie locale due à la compression locale de la tumeur sont considérées comme des mécanismes sous-jacents qui diminuent le seuil des crises (26). L’augmentation des niveaux de glutamate dans l’œdème péritumoral est souvent décrite comme un facteur instigateur de l’état d’hyperexcitabilité et d’épilepsie (8, 26).
L‘œdème est fortement corrélé à l’invasion du cerveau (35), et peut également être intimement associé à la localisation de la tumeur et à des méningiomes plus invasifs et de grades plus élevés (31, 32, 36). Notamment, Hess et al. ont rapporté une multiplication par cinq du volume de l’œdème chez les patients présentant une invasion cérébrale par rapport à ceux n’en présentant pas, avec une augmentation de 20 % du risque d’invasion cérébrale pour chaque augmentation de 1cm de l’œdème péritumoral (35). Chernov, et al. ont rapporté une incidence élevée d’œdème péritumoral dans les méningiomes invasifs macroscopiques (37). L’invasion cérébrale et la rupture de la couche arachnoïde déforment et altèrent le cortex péritumoral, libérant des acides aminés et affectant la voie des neurotransmetteurs (35, 38).
En ce qui concerne l’apparition de crises postopératoires, les fortes adhésions peropératoires, la nécessité de procéder à une microdissection, ainsi que les éventuelles lésions de la surface corticale et l’irritation peuvent contribuer à la génération, en particulier chez les patients n’ayant jamais eu de crises (36). La rétraction et la manipulation, qui sont parfois nécessaires pour obtenir une résection totale dans les lésions de la base du crâne, peuvent également entraîner des lésions corticales supplémentaires et un œdème (39). Les complications postopératoires telles que l’infection, l’hématome et l’hydrocéphalie peuvent encore accroître l’œdème cérébral et augmenter le risque de crises (40).
Sur la base des caractéristiques histopathologiques, le système de classification de l’OMS classe les méningiomes en grade I (bénin), grade II (atypique) et grade III (anaplasique) (41). Hess et al. ont analysé rétrospectivement l’invasion cérébrale et le risque de convulsions chez un total de 176 patients atteints de méningiomes. Il y avait 92 (52 %) tumeurs de grade I, 79 (45 %) de grade II, et 5 (3 %) de grade III. Les méningiomes de grade I comprenaient 16 (17 %) sous-types transitionnels, 4 (4 %) sécrétoires, 68 (74 %) méningothéliaux, 3 (3 %) fibreux et 1 (1 %) angiomateux. Les crises préopératoires étaient présentes chez 10 (11 %) des 92 patients atteints de méningiome de grade I, 23 (29 %) des 79 patients atteints de méningiome de grade II, et absentes chez les patients atteints de méningiome anaplasique. Dans les méningiomes de grade I, le sous-type histopathologique était significativement corrélé au taux d’épilepsie préopératoire. Globalement, le risque de crises épileptiques préopératoires était significativement plus élevé chez les patients présentant une tumeur de grade II ou III que chez ceux présentant une tumeur de grade I. L’invasion cérébrale était absente chez tous les patients présentant un méningiome de grade I, mais elle était présente chez 35 (44 %) des patients présentant un méningiome atypique et chez 3 (60 %) des patients présentant un méningiome anaplasique.
L’invasion cérébrale était indépendante du volume de la tumeur mais fortement corrélée au volume de l’œdème. Les analyses multivariées ont montré que le risque de crises préopératoires était nettement plus élevé chez les patients présentant un méningiome avec invasion cérébrale que chez ceux présentant un méningiome non invasif (OR 5,26, IC 95 % 1,52-18,15 ; p = 0,009).
Cependant, les taux d’absence de crises postopératoires étaient similaires chez les patients atteints de méningiome invasif et ceux atteints de méningiome non invasif. L’incidence de l’épilepsie postopératoire était corrélée de manière significative avec l’augmentation du volume tumoral préopératoire (35). Dans une autre étude rétrospective, Gadot et al. ont examiné les 384 patients qui ont subi une résection de méningiome. L’association significative n’a pas été trouvée entre un sous-type histologique et de plus mauvais résultats postopératoires en matière de crises d’épilepsie. Cependant, il y avait une tendance associative entre les sous-types de grades plus élevés (malin, rhabdoïde) avec de plus mauvais résultats postopératoires en matière de crises. Les sous-types de grades inférieurs (fibreux, transitionnel) avaient tendance à améliorer les résultats postopératoires (p = 0,081) (25). Il n’existe pas de données dans la littérature médicale pour les petits méningiomes fortuits, qui ne font pas partie du réseau épileptogène.
Facteurs prédictifs de l’épilepsie dans le cas du méningiome
Afin de mieux comprendre et prédire les crises d’épilepsie chez les patients atteints d’un méningiome, plusieurs études rétrospectives ont examiné les facteurs prédictifs possibles des crises tant en préopératoire qu’en postopératoire. Dans toute la littérature, l’œdème péritumoral et la localisation ont été associés aux crises dans les méningiomes. L’œdème péritumoral a fait l’objet d’études approfondies et est considéré comme le facteur prédictif le plus fort de crise tant en préopératoire qu’en postopératoire (7, 8, 17, 20, 21, 26, 35). La probabilité d’obtenir une absence de crise postopératoire est moindre chez les patients présentant un œdème préopératoire important (21, 42).
Facteurs prédictifs préopératoires
Les facteurs prédictifs préopératoires d’épilepsie/convulsions sont résumés dans le tableau 1.
TABLEAU 1
Tableau 1 Facteurs prédictifs de l’épilepsie/crises préopératoires.
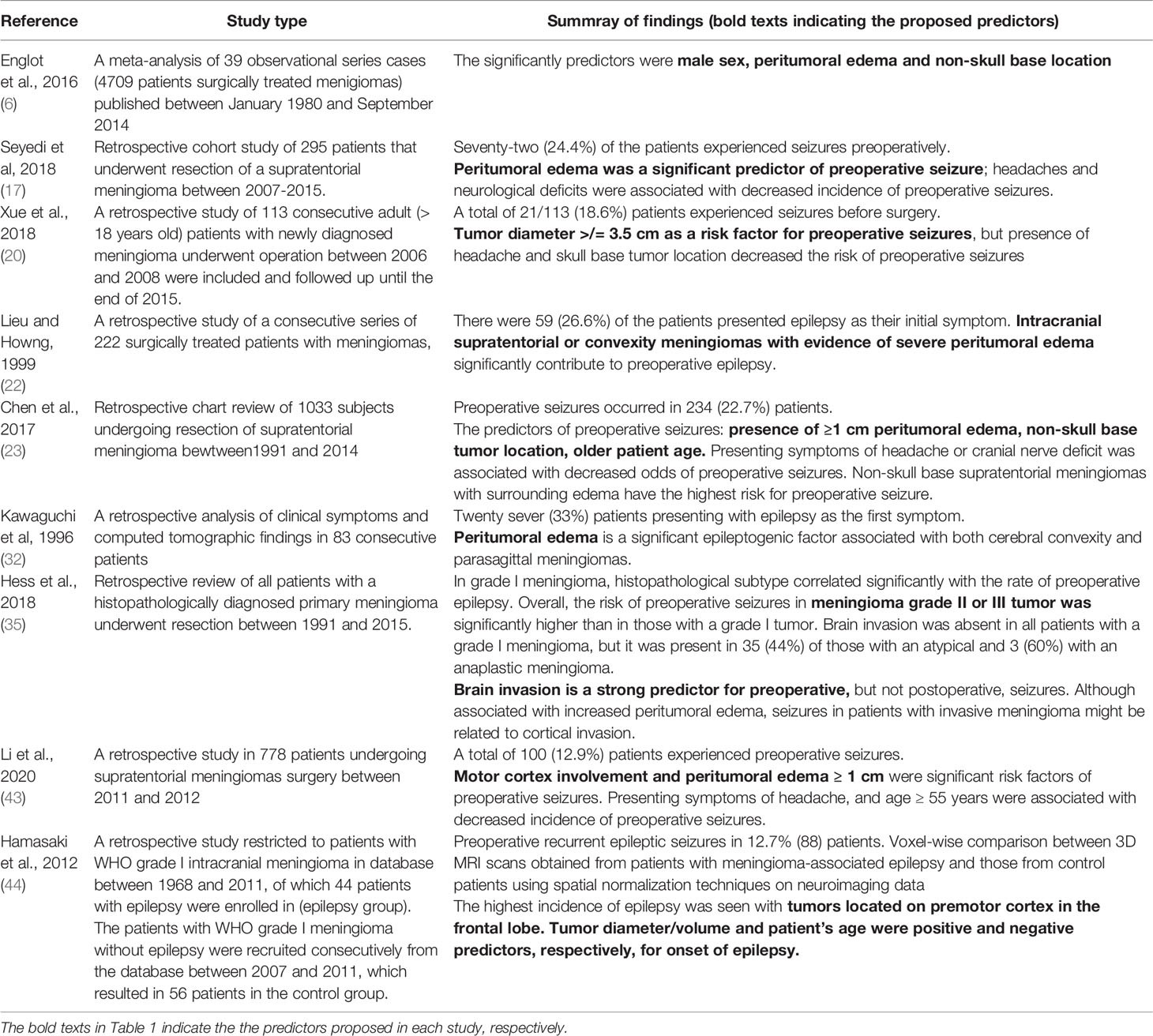
Dans une étude rétrospective de Li et al. L’œdème péritumoral de > 1cm était parmi les facteurs de risque identifiés pour les crises préopératoires chez les patients atteints de méningiome (43). La localisation de la tumeur dans les lobes temporal, pariétal et frontal (adjacent au néocortex) est plus susceptible d’être associée à des crises (7, 18, 20, 21). Plus précisément, Lieu et Howng ont noté que la tumeur située dans le lobe temporal augmentait le risque de crises préopératoires par rapport aux autres lobes. On pense que l’augmentation de l’œdème péritumoral remarqué dans les méningiomes convexes et parasagittaux favorise la probabilité d’une augmentation de la fréquence des crises chez les individus affectés. Les méningiomes qui ne sont pas à la base du crâne sont suggérés comme étant plus agressifs avec un indice MIB élevé (pourcentage de cellules tumorales immunoréactives) qui favorise l’invasion du cerveau, l’œdème et les crises (20, 45). Dans une autre étude, aucun consensus n’a été trouvé concernant la zone corticale la plus épileptogène (46).
La plupart des études suggèrent que des tumeurs plus grosses sont naturellement associées à un risque plus élevé de crise préopératoire. Il est concevable que des tumeurs plus grandes puissent causer plus d’irritation et de compression sur les tissus cérébraux environnants. Des résultats similaires rapportés par Chen et al. ont montré que les tumeurs de plus de 3 cm, de grade supérieur avec un œdème péritumoral de plus de 1 cm sont associées à des crises préopératoires (20). Dans une étude, aucune corrélation statistiquement significative entre la taille de la tumeur et les crises préopératoires n’a pu être trouvée (43), alors que le diamètre moyen de la tumeur de 3,5 cm a été utilisé comme seuil pour démontrer une association avec les crises postopératoires à l’hôpital.
Il est intéressant de noter que les méningiomes sont plus fréquents chez les femmes, mais que les hommes sont plus susceptibles de présenter des crises d’épilepsie. De nombreuses études ont montré que le sexe masculin est un facteur de risque de développer des crises préopératoires (7, 8, 20, 23, 43). Il existe une association possible entre le sexe masculin et un méningiome de grade plus élevé, une taille plus grande et un œdème plus important (20). Un âge plus jeune était un facteur prédictif (44), et une incidence plus faible de crises préopératoires a été trouvée chez les patients atteints de méningiomes âgés de plus de 55 ans (43).
D’autres facteurs comme le score de Karnofsky (KPS) préopératoire ont également été étudiés. Un KPS <80 était positivement associé aux crises préopératoires (40). Englot et al. ont rapporté une incidence réduite de crises préopératoires chez les patients présentant des déficits des nerfs crâniens (7). Cependant, les études sur la fréquence des symptômes présentent des limites. Des études prospectives sont nécessaires pour valider ces prédicteurs potentiels.
Facteurs prédictifs postopératoires
Les prédicteurs postopératoires d’épilepsie/convulsions sont résumés dans le tableau 2.
TABLEAU 2
Tableau 2 Prédicteurs de l’épilepsie/des crises postopératoires.
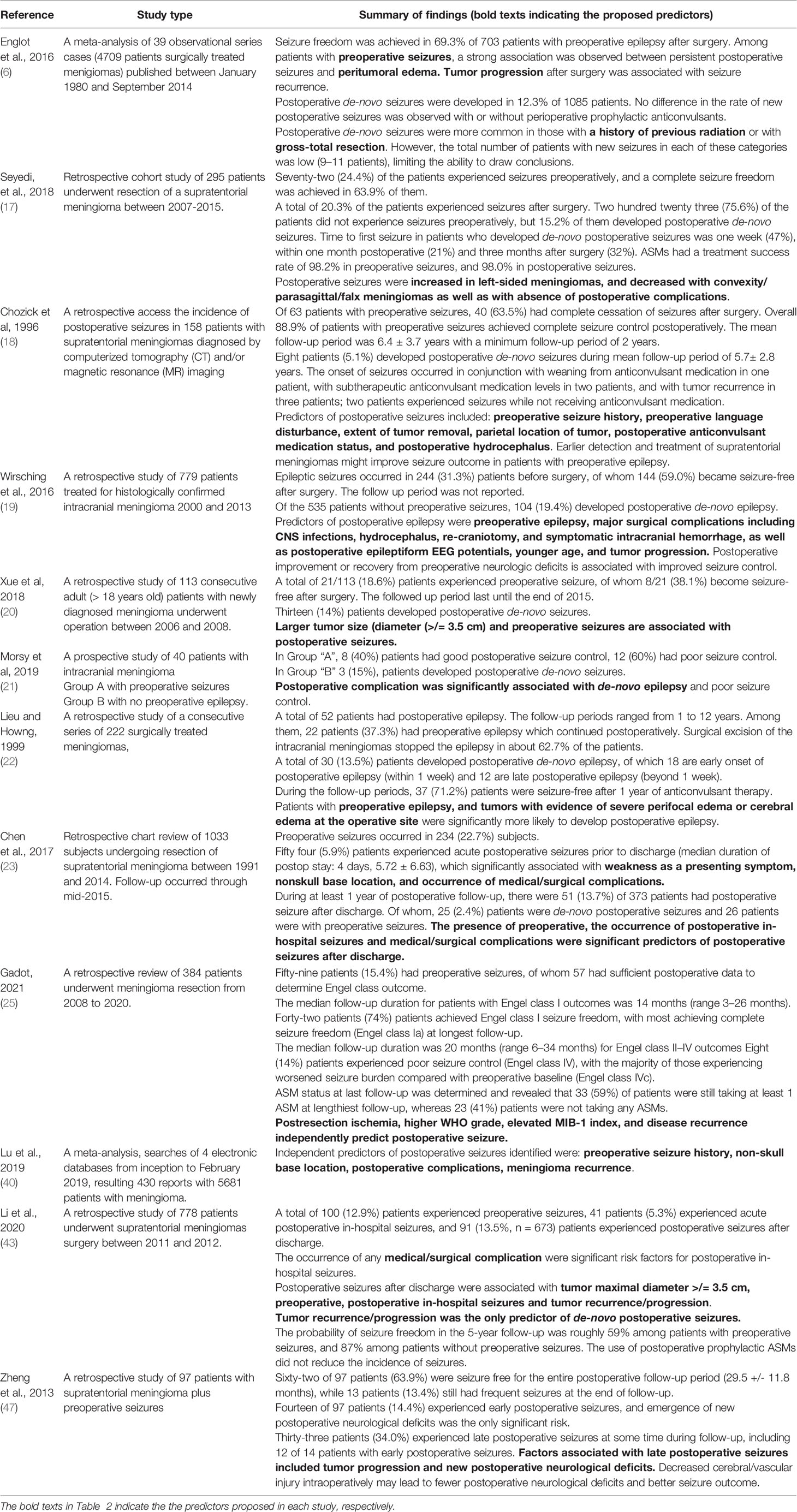
La Ligue internationale contre l’épilepsie (LICE) a défini les crises postopératoires aiguës comme des crises survenant dans les sept jours suivant la craniotomie (48). La crise postopératoire tardive est définie comme une crise d’épilepsie survenant au-delà de la première semaine de la chirurgie (21, 49). Dans une étude rétrospective portant sur 556 patients ayant subi une chirurgie du méningiome, 74 patients ont présenté des crises postopératoires, dont 43% de crises tardives (49). Certaines études ont catégorisé les crises postopératoires en crises précoces, tardives, à l’hôpital et après la sortie de l’hôpital. L’identification des prédicteurs possibles de crises postopératoires peut aider à guider le contrôle des crises et à minimiser les complications associées à l’utilisation à long terme des ASM (13, 17, 20, 43, 47, 50).
La localisation de la tumeur, sa taille, son grade, l’atteinte de la zone motrice et le KPS ont tous été étudiés comme facteurs prédictifs de crises postopératoires (21, 23). Dans une étude, la survenue de crises précoces à l’hôpital était associée à l’implication du cortex moteur, à un KPS postopératoire < 70, à des complications postopératoires et à des crises préopératoires (43). Il a été suggéré que la diminution du seuil et l’augmentation de la sensibilité du cortex pendant la période postopératoire immédiate sont des facteurs importants à prendre en compte, et que l’utilisation des ASM peut être justifiée pendant cette période. Le KPS < 80 était un prédicteur indépendant de crises postopératoires, avec un risque presque trois fois plus élevé d’avoir des crises préopératoires (40). Ceci explique encore l’impact des crises sur la qualité de vie. Les lésions de la base du crâne ont été associées à une diminution de l’incidence des crises en préopératoire, avec une tendance opposée et une incidence accrue en postopératoire (40). Chen et al, dans une étude portant sur 1033 patients, ont rapporté une diminution de l’incidence des crises dans les lésions de la base du crâne (20). Les lésions de la base du crâne nécessitent une plus grande rétraction du cerveau, ce qui augmente encore l’œdème cérébral (7, 51). Scott et al. ont noté une association entre le méningiome du côté gauche et un plus grand risque de développer des crises (52), avec des taux plus élevés de crises postopératoires rapportés dans l’hémisphère gauche (66,7%) par rapport à l’hémisphère droit (23,3%) (17). Dans une étude radiologique analysant l’imagerie par résonance magnétique (IRM) structurelle en 3D de patients atteints de méningiomes afin d’identifier les points chauds pour les crises, les résultats ont montré une probabilité élevée de crises lorsque la lésion était située sur le cortex moteur du lobe frontal (44).
Les crises préopératoires étaient de forts prédicteurs de crises postopératoires, en particulier de crises non contrôlées (13, 17, 20, 43). Il y a une contradiction dans la littérature concernant les déficits neurologiques comme symptômes de présentation. Dans certaines études, il était associé à une moindre incidence de crises préopératoires (17, 20), et dans d’autres, il s’est avéré être significativement associé à des crises postopératoires avant la sortie (10, 19). Lors d’une analyse univariée, Chen et al. ont constaté qu’un déficit neurologique sous la forme d’une nouvelle faiblesse, d’une pneumonie, d’un hématome et d’un infarctus avec œdème était significativement associé à des crises à l’hôpital. Dans leur étude, la faiblesse était un facteur prédictif de crises à l’hôpital mais pas avant ou après la sortie de l’hôpital (20). Il est intéressant de noter que Wirsching et al. ont constaté que l’amélioration postopératoire et la récupération des déficits neurologiques préopératoires étaient associées à un risque plus faible de crise postopératoire et à un meilleur contrôle (19).
Les complications postopératoires sont des prédicteurs indépendants de crises postopératoires (20). Dans la période postopératoire immédiate, le cerveau est plus sensible et son seuil de convulsion est abaissé (43). Toute irritation du néocortex très sensible et probablement encore œdémateux peut aggraver les crises immédiatement après la chirurgie. Une corrélation positive a été établie entre les complications postopératoires comme l’hématome, l’hydrocéphalie, l’infection et l’œdème (40). De nouveaux déficits neurologiques postopératoires permanents, en particulier chez les patients présentant des lésions vasculaires, ont augmenté de manière significative le risque de crises postopératoires (47). Wirshing et al. ont spécifié les complications chirurgicales majeures comme les infections du système nerveux central, l’hydrocéphalie, la re-craniotomie et l’hémorragie intracrânienne symptomatique comme facteurs de risque de crises postopératoires (19).
Pour les crises après la sortie de l’hôpital, Li et al. ont identifié la taille de la tumeur > 3,5 cm, les crises préopératoires et la progression de la tumeur comme des facteurs prédictifs importants (43). Dans la même étude, les complications postopératoires étaient associées aux crises postopératoires aiguës, mais aucune corrélation avec les crises postopératoires lors du suivi à long terme. Dans une autre étude, les complications chirurgicales étaient associées à des crises à l’hôpital et à des crises après la sortie de l’hôpital chez les patients n’ayant jamais eu de crises (19, 53). Chen et al. n’ont pas trouvé que la récidive tumorale ou la résection subtotale étaient des facteurs prédictifs importants de crises postopératoires (20). Englot et al. ont trouvé une forte association entre les déficits des nerfs crâniens et les crises après la sortie de l’hôpital lors d’une analyse univariée (7).
Résection chirurgicale et liberté d’épilepsie
L’amélioration des techniques chirurgicales et le diagnostic plus précoce du méningiome ont eu une incidence sur l’étendue de la résection avec des résultats favorables. Comme indiqué précédemment, la chirurgie permet d’éliminer les crises d’épilepsie chez 70 % des patients, avec des taux allant de 19 % à 90 % (7, 21). Dans certaines études, la liberté globale de crise sur un suivi de 5 ans était de 87% chez les patients ayant des crises préopératoires et de 59% chez les patients naïfs de crises (4, 43). Lu et al. ont rapporté un taux de 30-40% de crises postopératoires chez les patients ayant des antécédents de crises avant l’opération et 10-15% chez les patients naïfs de crises (40). Komotar et al. ont montré une influence significative de la résection totale brute sur les taux de crises (54). Ces rapports soutiennent l’intervention chirurgicale et la cytoréduction chez les patients présentant des crises persistantes. En revanche, on a signalé que les nouvelles crises postopératoires étaient plus fréquentes chez les patients ayant subi une résection totale grossière (46). Une explication possible est qu’une manipulation, une dissection et une rétraction plus importantes du cerveau pour réaliser une résection totale grossière peuvent provoquer des lésions corticales, une irritation, un œdème et des crises. Dans une étude, la résection de grade I de Simpson était corrélée à des crises postopératoires (39). La plupart de ces lésions étaient des méningiomes à convexité, qui sont fortement corrélés avec les crises d’épilepsie. Par conséquent, le classement de Simpson n’était pas cliniquement pertinent dans cette étude. Des résultats similaires ont été rapportés par Hess et al, sans qu’aucune signification statistique ne soit notée entre le grade de Simpson et les crises postopératoires (35). De multiples études ont montré une association entre les crises et la récurrence/progression tumorale (23, 47). Une théorie postulée est qu’il y a une possible réactivation d’un foyer épileptogène antérieur ou la formation d’un nouveau foyer avec la récurrence de la tumeur (40, 43). Les lésions de grade I de l’OMS ont de faibles taux de récidive et, en cas de résection totale grossière, cela peut être un facteur de protection contre les crises postopératoires (4, 5).
La plupart des données de la littérature font état d’une absence de crises après une craniotomie et une résection, et peu d’études traitent d’autres modalités de traitement comme la radiochirurgie. Kondziolka et al. ont rapporté un cas de mortalité sans plus de détails (54). Dans l’étude de Zada portant sur 116 patients ayant subi un traitement par couteau gamma pour un méningiome, il n’y a eu aucun cas de crise sur les 75 mois de suivi (55). Pollack et al. ont signalé un taux de 1,6 % de crises nouvelles ou aggravées après la radiochirurgie (56). Une diminution des taux de liberté de crise a été rapportée après la chirurgie chez des patients ayant des crises intraitables en préopératoire (40).
Gestion de l’épilepsie non contrôlée liée à un méningiome ; médicaments et chirurgie de l’épilepsie
L’Académie américaine de neurologie ne recommande pas l’utilisation prophylactique des ASM dans les cas de tumeurs cérébrales nouvellement diagnostiquées. Dans notre institution, nous ne préconisons pas l’obtention d’un EEG préopératoire pour aider à déterminer si le patient doit être placé sous ASM. Pourtant, certains chirurgiens préconisent l’utilisation prophylactique des ASM dans la période postopératoire immédiate afin de prévenir les crises dé-novo (57). Dans une étude de Zheng et al. les ASM ont réduit le risque de crises postopératoires précoces (8, 58). Les ASM peuvent être utilisés chez les patients présentant des crises préopératoires comme mesure temporaire jusqu’à la résection chirurgicale. On estime que 40 % des patients dont les crises étaient bien contrôlées avant l’intervention chirurgicale ont pu être sevrés des ASM au cours des 27 mois postopératoires, et que seuls 22 % sont restés avec des crises intraitables (8). Pour une meilleure sélection des patients et une meilleure utilisation des ASM en postopératoire, le système de notation STAMPE a été une tentative pour aider à guider le traitement de l’épilepsie chez les patients atteints de méningiome (19). Ils ont proposé un système de notation simple comprenant des facteurs de risque possibles tels que le déficit sensorimoteur, la progression de la tumeur, l’âge < 55 ans, une complication chirurgicale majeure, les crises préopératoires, l’EEG postopératoire et l’œdème cérébral. Les résultats n’étaient cependant pas statistiquement significatifs et nécessitaient une validation supplémentaire.
L’évaluation de la chirurgie de l’épilepsie en vue d’une résection plus poussée après avoir délimité la zone épileptogène par une surveillance EEG intracrânienne (grilles, bandes ou électrodes stéréotaxiques), y compris l’ECoG peropératoire, est l’approche de référence dans les centres d’épilepsie de niveau 4 pour les patients atteints d’épilepsies lésionnelles qui n’ont pas répondu à au moins deux ASM correctement sélectionnés et dosés. L’EEG peut être utile pour évaluer la récurrence des crises lors du sevrage ou de l’arrêt des ASM. Plusieurs études ont suggéré l’utilisation systématique de l’EEG en postopératoire pour prédire la récurrence des crises. Dans une étude portant sur 340 patients, la décharge épileptiforme a permis de prédire les crises postopératoires, ce qui plaide en faveur de l’utilisation systématique de l’EEG en postopératoire (19). La cartographie peropératoire de l’ECoG et la résection du foyer de crise secondaire dans le cortex péritumoral peuvent augmenter les taux d’absence de crise postopératoire (23, 27). L’EEG postopératoire avec des décharges épileptiformes est suggéré comme prédicteur de l’apparition de crises postopératoires (19, 59). Cependant, l’académie américaine de neurologie a publié une directive de pratique chez les patients adultes épileptiques qui ont obtenu une absence de crise (mais pas spécifiquement pour le méningiome), la commande d’un EEG pour détecter les décharges épileptiformes interictales n’est pas utile pour guider la décision de poursuite de l’ASM. Cependant, cette approche est plus fiable chez les patients pédiatriques. Un potentiel épileptiforme sur l’EEG chez les patients pédiatriques augmente le risque de récurrence des crises (60).
Dans notre centre, nous évaluons chaque patient souffrant d’une épilepsie liée à un méningiome, en particulier les patients qui continuent à avoir des crises postopératoires non contrôlées avec l’implantation d’électrodes stéréotaxiques profondes (S-EEG) ou par des électrodes sous-durales à grille/bande, et dans les cas où la cartographie fonctionnelle est essentielle pour exclure l’implication du cortex éloquent de la zone épileptogène. La S-EEG constitue une option plus sûre pour les patients qui doivent subir une seconde intervention chirurgicale, sachant que les complications de l’intervention précédente, telles que les adhérences, les infections, les saignements, etc. sont susceptibles de poser problème. La cartographie fonctionnelle brute peut également être réalisée par l’EEG-S en comparaison avec la cartographie fonctionnelle détaillée réalisée par des électrodes en grille ou en bande. Dans les zones où une résection plus sûre est possible en dehors des cortex éloquents, l’EEG-S est utile pour englober les bords de la lésion et pour atteindre des zones d’intérêt éloignées, comme les structures temporales mésiales, afin d’exclure une double pathologie.
Le cas suivant illustre notre propre expérience dans la gestion des crises postopératoires après une résection de méningiome. Un homme de 36 ans, gaucher, qui a subi une résection d’un méningiome supérieur parasagittal médian gauche (6 x 7 cm) a développé des crises d’épilepsie d’apparition récente 8 à 10 mois après l’opération. Son IRM 3 mois après l’opération a montré une résection complète de la tumeur. Environ 11 mois après la résection, il a développé sa première crise » tonico-clonique « . Cela a commencé par un engourdissement, une faiblesse et des picotements du côté droit de son dos, descendant vers le milieu de sa colonne vertébrale. Il a ensuite été mis sous Lamotrigine, mais a continué à avoir des crises répétées qui commençaient par les mêmes sensations de fourmillement jusqu’à la colonne vertébrale, associées à des sensations anormales de papillon dans l’abdomen, pour finalement aboutir à des mouvements de tremblement du pied droit, avec une propagation au bras droit. En raison du développement d’une épilepsie résistante aux médicaments (ERD), y compris la lamotrigine, le lacosamide et le levetiracetam, il a subi une évaluation chirurgicale supplémentaire de l’épilepsie, y compris un EEG vidéo du cuir chevelu et une surveillance EEG intracrânienne avec une surveillance stéréotaxique S-EEG intracrânienne, ce qui a permis de mieux délimiter la zone épileptogène dans les canaux frontaux centraux et paracentraux gauches derrière les marges postérieures et mésiales de la cavité chirurgicale, avec probablement une apparition plus précoce sur la surface mésiale du côté gauche de la fissure interhémisphérique étant donné l’implication précoce du pied droit (Figure 1). Environ 25 mois après la chirurgie initiale, il a subi une deuxième craniotomie frontale gauche programmée pour la résection des foyers épileptogènes. Il a continué à prendre des médicaments anticonvulsivants après l’opération et a signalé une amélioration de la fréquence des crises. Depuis qu’il a subi sa deuxième chirurgie, il y a eu une réduction notable de la fréquence des crises, qui est passée de deux fois par semaine à deux fois par an, de type focal conscient déclenché par la réduction des médicaments ou la consommation d’alcool.
IRM 1
IRM 1 Les cercles représentent les décharges épileptiformes interictales actives (les zones irritatives). Les étoiles représentent les premiers contacts impliqués au début de l’épisode épileptique. Les lignes pointillées représentent la zone de résection proposée.
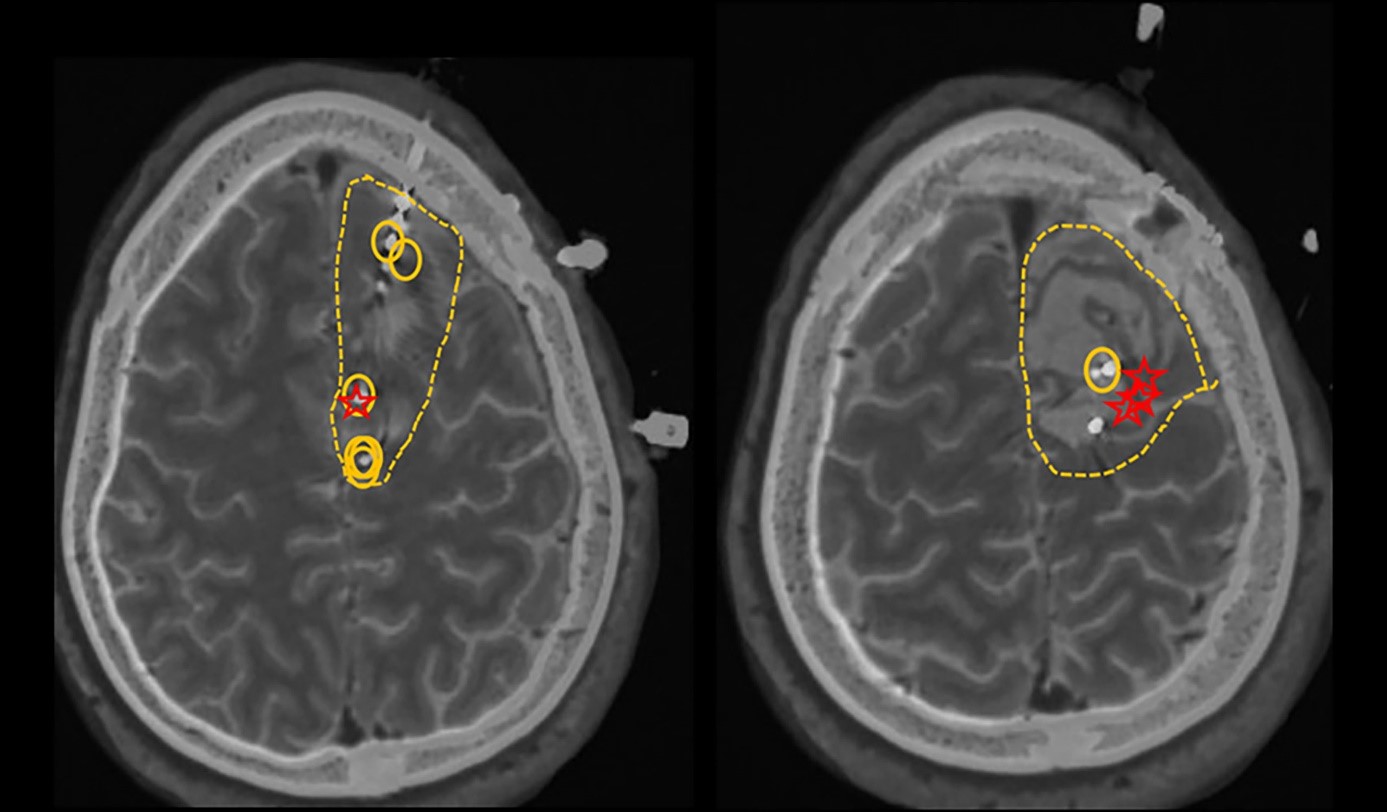
Ce rapport de cas est utilisé comme exemple pour montrer la complexité de la gestion d’un patient atteint d’un méningiome ayant subi une craniotomie. Un projet séparé approuvé par l’IRB sera réalisé pour analyser rétrospectivement le taux de réussite de telles procédures dans notre centre.
En ce qui concerne le traitement médical des tumeurs cérébrales primaires (TCP) en général, il n’existe pas d’études solides et randomisées pour étayer le choix des ASM. Plusieurs facteurs doivent être pris en considération, notamment le sexe, l’âge, le coût, la profession, la cognition, les effets secondaires courants des médicaments, la base neurologique liée à la tumeur/chirurgie (afin d’éviter l’addition des effets indésirables des médicaments), la pharmacocinétique des médicaments, les interactions médicamenteuses, l’efficacité et les comorbidités. Il faut également tenir compte de l’interaction avec les traitements de chimiothérapie et de l’effet des radiations sur le cerveau. Certains types de tumeurs (comme les tumeurs de bas grade) sont connus pour être résistants au traitement par les ASM en raison de plusieurs hypothèses comme la sévérité intrinsèque du mécanisme sous-jacent de l’épileptogénicité, l’expression altérée des molécules sur lesquelles les ASM agissent ou la modification de l’expression des transporteurs au niveau de la barrière hémato-encéphalique limitant la pénétration du médicament dans le tissu épileptogène (61). Les ASM les plus récents (oxcarbazépine, topiramate, lamotrigine, levetiracetam, zonisamide et lacosamide) présentent une meilleure tolérance et une meilleure efficacité en raison de différents aspects, notamment leur propriété de ne pas induire d’enzyme, leur interaction limitée entre médicaments, leur excrétion rénale pure et leurs effets secondaires moindres. Les ASM d’ancienne génération comme la carbamazépine, la phénytoïne et le phénobarbital sont en train de tomber en désuétude en raison de leur forte liaison protéique, des interactions médicamenteuses et de l’induction du P-450 hépatique. Les effets indésirables des ASM sont signalés comme étant plus élevés chez les patients PBT que dans la population générale des épileptiques (24% vs 0,5-12%) (57). Dans les PBTs, les effets indésirables des ASMs dirigés vers la fonction cérébrale telle que la fonction exécutive, la capacité d’attention, la fonction cognitive sont six fois plus élevés que les effets indésirables liés à l’irradiation du cerveau (62). Dans l’ensemble, le meilleur rapport risque-bénéfice du choix de l’ASM à utiliser est basé sur le jugement du médecin. Il est très important de mentionner que le traitement doit être commencé après une seule crise. Selon les recommandations de l’Académie américaine de neurologie (AAN), il n’est pas nécessaire d’administrer un traitement prophylactique par ASM aux patients atteints de tumeurs cérébrales sans antécédents de crises. Il est également suggéré que la diminution progressive et l’arrêt des ASM après la première semaine postopératoire sont appropriés en l’absence d’antécédents de crises (57). En résumé, la stratégie de sélection des médicaments pour la prise en charge de la BTRE doit favoriser les médicaments à administration parentérale, les ASM qui ne nécessitent pas une titration lente, et doit éviter les ASM inducteurs enzymatiques. En cas d’échec de la monothérapie, il faut envisager une thérapie combinée, une mauvaise observance, une chirurgie répétée et une récurrence/progression tumorale.
L’efficacité de chaque ASM est très variable : oxcarbazépine en monothérapie : 62,9 % ; topiramate en monothérapie : 55,6 % ; gabapentine, prégabaline, tiagabine, zonisamide en traitement d’appoint : 27,4 à 100 % ; levetiracetam en monothérapie et en traitement d’appoint : 47,4% à 88% ; lacosamide comme médicament d’appoint avec 42,9% (63). Le lévétiracétam et l’acide valproïque sont les médicaments les plus étudiés dans l’épilepsie liée aux tumeurs. Le lévétiracétam a été étudié par rapport à l’acide valproïque et l’échec du traitement des crises dans le glioblastome était de 33% contre 50%, peut-être en raison de sa tolérance et de sa propriété de renforcer l’inhibition de la méthylguanine-ADN méthyltransférase médiée par p53 dans cette population de patients (64). Les facteurs les plus attrayants pour la popularité du levetiracetam sont sa bonne tolérance, sa facilité d’utilisation sans besoin de titration, l’absence d’interaction avec d’autres ASM, sa non-métabolisation hépatique par le CYP450, et donc l’absence d’interaction avec certains médicaments de chimiothérapie utilisés dans certains cas de BTRE, et enfin une bonne couverture d’assurance.
Dans une récente enquête publiée sur les préférences de prescription des ASM parmi les neuro-oncologues européens, le levetiracetam est considéré comme le premier choix pour les patients atteints de tumeurs cérébrales, avec l’efficacité présumée la plus élevée et les effets indésirables les plus faibles (65). Les ASM diffèrent par leur pharmacocinétique, leur efficacité thérapeutique et leurs effets secondaires, qui ont été examinés en détail par Maschio (63).
La prise en charge des crises doit aller au-delà des options pharmacologiques. Les crises non traitées peuvent exposer les patients à un risque d’issue catastrophique, comme la mort subite inattendue chez les patients épileptiques. En outre, les crises peuvent avoir un impact négatif sur le mode de vie des patients, notamment sur le travail, l’emploi, l’éducation et la conduite automobile. Le risque de blessure physique ou de décès n’est pas limité au conducteur et aux passagers, mais s’applique aux piétons et aux personnes se trouvant dans d’autres véhicules. Les différents États américains ont des lois différentes pour déterminer quel groupe de patients épileptiques peut conduire. Les crises peuvent entraîner d’autres blessures physiques. Les patients souffrant d’épilepsie réfractaire doivent être traités dans des centres tertiaires où ils peuvent bénéficier d’un soutien médical, social et comportemental et, surtout, d’une évaluation en vue d’une chirurgie épileptique.
Perspectives d’avenir
Malgré les progrès réalisés dans la compréhension des mécanismes physiopathologiques et la prise en charge de l’épilepsie liée aux méningiomes, d’importantes lacunes dans les connaissances subsistent.
Parmi les questions pertinentes, citons : » quels sont les patients les plus exposés au risque de crises épileptiques ? » et » quand commencer les ASM et pendant combien de temps ? « .
Le risque de crises postopératoires persistantes souligne la nécessité de poursuivre les recherches sur le contrôle des crises chez les patients atteints de méningiome. L’utilisation arbitraire et à long terme des ASM chez les patients atteints de méningiome souligne l’importance des directives pour une sélection appropriée des patients. Ainsi, des essais prospectifs randomisés sont nécessaires pour guider la sélection et la prescription des ASM. STOP ‘EM est un essai contrôlé randomisé en cours, dont la date de fin est fixée à septembre 2027 (66). Il vise à déterminer la nécessité de recourir à des ASM en postopératoire chez les patients n’ayant jamais eu de crise épileptique. Les principaux objectifs de l’étude sont de déterminer l’efficacité du lévétiracétam dans la prévention des crises sur une période de 12 mois après la chirurgie, l’effet de la mise en route du lévétiracétam sur la capacité à reprendre la conduite, la qualité de vie et le rapport coût-efficacité.
Conclusion
Comprendre et prédire les crises d’épilepsie liées à un méningiome peut aider à guider le contrôle des crises et permettre de mieux déterminer les patients à risque avant et après la chirurgie. La littérature médicale actuelle fournit des données limitées pour la prédiction des crises postopératoires et la gestion optimale des patients atteints d’épilepsie liée à un méningiome.
En ce qui concerne la cohorte de patients atteints de méningiome et subissant une intervention chirurgicale, stratifiée en fonction de l’état de crise préopératoire par rapport à l’état de crise postopératoire, il est logique d’identifier quatre groupes différents :
- sans crise par rapport à l’état de crise,
- avec crise par rapport à l’état de crise,
- sans crise par rapport à l’état de crise
- et avec crise par rapport à l’état de crise.
Les efforts futurs de stratification des patients dans ces quatre groupes, y compris les médicaments seuls, la chirurgie/les interventions seules, les médicaments + la chirurgie/les interventions, permettront de prédire le résultat de l’intervention chirurgicale et de traiter les patients de manière optimale avec les modalités les plus efficaces.
Contributions des auteurs
RE, HT, LH, WB et FB ont contribué à la conception et au design de l’étude. RE a rédigé la première version du manuscrit. AA a rédigé des sections du manuscrit. HT, LH, AA, WB et FB ont contribué à la révision du manuscrit. Tous les auteurs ont approuvé la version soumise.
Conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Note de l’éditeur
Toutes les affirmations exprimées dans cet article n’engagent que les auteurs et ne représentent pas nécessairement celles de leurs organisations affiliées, ni celles de l’éditeur, des rédacteurs et des réviseurs. Tout produit évalué dans cet article, ou toute revendication faite par son fabricant, n’est ni garanti ni approuvé par l’éditeur.
Remerciements
Cette étude a été soutenue par la subvention (n° 19140900105) du Comité des sciences et des technologies de Shanghai et par le Fonds de recherche du département de neurochirurgie de l’Université de Loma Linda.
Références
- Wiemels J, Wrensch M, Claus EB. Epidemiology and Etiology of Meningioma. J Neurooncol (2010) 99(3):307–14. doi: 10.1007/s11060-010-0386-3
PubMed Abstract | CrossRef Full Text | Google Scholar
- Porter KR, McCarthy BJ, Freels S, Kim Y, Davis FG. Prevalence Estimates for Primary Brain Tumors in the United States by Age, Gender, Behavior, and Histology. Neuro Oncol (2010) 12(6):520–7. doi: 10.1093/neuonc/nop066
PubMed Abstract | CrossRef Full Text | Google Scholar
- Ostrom QT, Gittleman H, Fulop J, Liu M, Blanda R, Kromer C, et al. CBTRUS Statistical Report: Primary Brain and Central Nervous System Tumors Diagnosed in the United States in 2008-2012. Neuro Oncol (2015) 17 Suppl 4:iv1–iv62. doi: 10.1093/neuonc/nov189
PubMed Abstract | CrossRef Full Text | Google Scholar
- Sughrue ME, Kane AJ, Shangari G, Rutkowski MJ, McDermott MW, Berger MS, et al. The Relevance of Simpson Grade I and II Resection in Modern Neurosurgical Treatment of World Health Organization Grade I Meningiomas. J Neurosurg (2010) 113(5):1029–35. doi: 10.3171/2010.3.JNS091971
PubMed Abstract | CrossRef Full Text | Google Scholar
- Hasseleid BF, Meling TR, Ronning P, Scheie D, Helseth E. Surgery for Convexity Meningioma: Simpson Grade I Resection as the Goal: Clinical Article. J Neurosurg (2012) 117(6):999–1006. doi: 10.3171/2012.9.JNS12294
PubMed Abstract | CrossRef Full Text | Google Scholar
- Erturk Cetin O, Isler C, Uzan M, Ozkara C. Epilepsy-Related Brain Tumors. Seizure (2017) 44:93–7. doi: 10.1016/j.seizure.2016.12.012
PubMed Abstract | CrossRef Full Text | Google Scholar
- Englot DJ, Magill ST, Han SJ, Chang EF, Berger MS, McDermott MW. Seizures in Supratentorial Meningioma: A Systematic Review and Meta-Analysis. J Neurosurg (2016) 124(6):1552–61. doi: 10.3171/2015.4.JNS142742
PubMed Abstract | CrossRef Full Text | Google Scholar
- Chaichana KL, Pendleton C, Zaidi H, Olivi A, Weingart JD, Gallia GL, et al. Seizure Control for Patients Undergoing Meningioma Surgery. World Neurosurg (2013) 79(3-4):515–24. doi: 10.1016/j.wneu.2012.02.051
PubMed Abstract | CrossRef Full Text | Google Scholar
- Van Breemen MS, Wilms EB, Vecht CJ. Seizure Control in Brain Tumors. Handb Clin Neurol (2012) 104:381–9. doi: 10.1016/B978-0-444-52138-5.00026-8
PubMed Abstract | CrossRef Full Text | Google Scholar
- Bauer R, Ortler M, Seiz-Rosenhagen M, Maier R, Anton JV, Unterberger I. Treatment of Epileptic Seizures in Brain Tumors: A Critical Review. Neurosurg Rev (2014) 37(3):381–8:discussion 8. doi: 10.1007/s10143-014-0538-6
PubMed Abstract | CrossRef Full Text | Google Scholar
- Taphoorn MJ, Klein M. Cognitive Deficits in Adult Patients With Brain Tumours. Lancet Neurol (2004) 3(3):159–68. doi: 10.1016/S1474-4422(04)00680-5
PubMed Abstract | CrossRef Full Text | Google Scholar
- Gilliam F, Kuzniecky R, Faught E, Black L, Carpenter G, Schrodt R. Patient-Validated Content of Epilepsy-Specific Quality-of-Life Measurement. Epilepsia (1997) 38(2):233–6. doi: 10.1111/j.1528-1157.1997.tb01102.x
PubMed Abstract | CrossRef Full Text | Google Scholar
- Chaichana KL, Parker SL, Olivi A, Quinones-Hinojosa A. Long-Term Seizure Outcomes in Adult Patients Undergoing Primary Resection of Malignant Brain Astrocytomas. Clinical Article. J Neurosurg (2009) 111(2):282–92. doi: 10.3171/2009.2.JNS081132
PubMed Abstract | CrossRef Full Text | Google Scholar
- Harden CL. The Co-Morbidity of Depression and Epilepsy: Epidemiology, Etiology, and Treatment. Neurology (2002) 59(6 Suppl 4):S48–55. doi: 10.1212/WNL.59.6_suppl_4.S48
PubMed Abstract | CrossRef Full Text | Google Scholar
- Cramer JA, Mintzer S, Wheless J, Mattson RH. Adverse Effects of Antiepileptic Drugs: A Brief Overview of Important Issues. Expert Rev Neurother (2010) 10(6):885–91. doi: 10.1586/ern.10.71
PubMed Abstract | CrossRef Full Text | Google Scholar
- Hamasaki T, Yamada K, Kuratsu J. Seizures as a Presenting Symptom in Neurosurgical Patients: A Retrospective Single-Institution Analysis. Clin Neurol Neurosurg (2013) 115(11):2336–40. doi: 10.1016/j.clineuro.2013.08.016
PubMed Abstract | CrossRef Full Text | Google Scholar
- Seyedi JF, Pedersen CB, Poulsen FR. Risk of Seizures Before and After Neurosurgical Treatment of Intracranial Meningiomas. Clin Neurol Neurosurg (2018) 165:60–6. doi: 10.1016/j.clineuro.2018.01.002
PubMed Abstract | CrossRef Full Text | Google Scholar
- Chozick BS, Reinert SE, Greenblatt SH. Incidence of Seizures After Surgery for Supratentorial Meningiomas: A Modern Analysis. J Neurosurg (1996) 84(3):382–6. doi: 10.3171/jns.1996.84.3.0382
PubMed Abstract | CrossRef Full Text | Google Scholar
- Wirsching HG, Morel C, Gmur C, Neidert MC, Baumann CR, Valavanis A, et al. Predicting Outcome of Epilepsy After Meningioma Resection. Neuro Oncol (2016) 18(7):1002–10. doi: 10.1093/neuonc/nov303
PubMed Abstract | CrossRef Full Text | Google Scholar
- Chen WC, Magill ST, Englot DJ, Baal JD, Wagle S, Rick JW, et al. Factors Associated With Pre- and Postoperative Seizures in 1033 Patients Undergoing Supratentorial Meningioma Resection. Neurosurgery (2017) 81(2):297–306. doi: 10.1093/neuros/nyx001
PubMed Abstract | CrossRef Full Text | Google Scholar
- Lieu AS, Howng SL. Intracranial Meningiomas and Epilepsy: Incidence, Prognosis and Influencing Factors. Epilepsy Res (2000) 38(1):45–52. doi: 10.1016/S0920-1211(99)00066-2
PubMed Abstract | CrossRef Full Text | Google Scholar
- Morsy MM, El-Saadany WF, Moussa WM, Sultan AE. Predictive Factors for Seizures Accompanying Intracranial Meningiomas. Asian J Neurosurg (2019) 14(2):403–9. doi: 10.4103/ajns.AJNS_152_18
PubMed Abstract | CrossRef Full Text | Google Scholar
- Xue H, Sveinsson O, Bartek J Jr., Forander P, Skyrman S, Kihlstrom L, et al. Long-Term Control and Predictors of Seizures in Intracranial Meningioma Surgery: A Population-Based Study. Acta Neurochir (Wien) (2018) 160(3):589–96. doi: 10.1007/s00701-017-3434-3
PubMed Abstract | CrossRef Full Text | Google Scholar
- Schaller B. Brain Tumor and Seizures: Pathophysiology and its Implications for Treatment Revisited (Epilepsia 2003; 44:1223-1232). Epilepsia (2006) 47(3):661; discussion. doi: 10.1111/j.1528-1167.2006.00484_1.x
CrossRef Full Text | Google Scholar
- Gadot R, Khan AB, Patel R, Goethe E, Shetty A, Hadley CC, et al. Predictors of Postoperative Seizure Outcome in Supratentorial Meningioma. J Neurosurg (2021), 1–10. doi: 10.3171/2021.9.JNS211738
PubMed Abstract | CrossRef Full Text | Google Scholar
- Shamji MF, Fric-Shamji EC, Benoit BG. Brain Tumors and Epilepsy: Pathophysiology of Peritumoral Changes. Neurosurg Rev (2009) 32(3):275–84; discussion 84-6. doi: 10.1007/s10143-009-0191-7
PubMed Abstract | CrossRef Full Text | Google Scholar
- Fang S, Zhan Y, Xie YF, Shi Q, Dan W. Predictive Value of Electrocorticography for Postoperative Epilepsy in Patients With Supratentorial Meningioma. J Clin Neurosci (2013) 20(1):112–6. doi: 10.1016/j.jocn.2012.02.021
PubMed Abstract | CrossRef Full Text | Google Scholar
- van Diessen E, Diederen SJ, Braun KP, Jansen FE, Stam CJ. Functional and Structural Brain Networks in Epilepsy: What Have We Learned? Epilepsia (2013) 54(11):1855–65. doi: 10.1111/epi.12350
PubMed Abstract | CrossRef Full Text | Google Scholar
- Mehta N, Bhagwati S, Parulekar G. Meningiomas in Children: A Study of 18 Cases. J Pediatr Neurosci (2009) 4(2):61–5. doi: 10.4103/1817-1745.57322
PubMed Abstract | CrossRef Full Text | Google Scholar
- Simis A, Pires de Aguiar PH, Leite CC, Santana PA Jr., Rosemberg S, Teixeira MJ. Peritumoral Brain Edema in Benign Meningiomas: Correlation With Clinical, Radiologic, and Surgical Factors and Possible Role on Recurrence. Surg Neurol (2008) 70(5):471–7; discussion 7. doi: 10.1016/j.surneu.2008.03.006
PubMed Abstract | CrossRef Full Text | Google Scholar
- Lobato RD, Alday R, Gomez PA, Rivas JJ, Dominguez J, Cabrera A, et al. Brain Oedema in Patients With Intracranial Meningioma. Correlation Between Clinical, Radiological, and Histological Factors and the Presence and Intensity of Oedema. Acta Neurochir (Wien) (1996) 138(5):485–93; discussion 93-4. doi: 10.1007/BF01411166
PubMed Abstract | CrossRef Full Text | Google Scholar
- Kawaguchi T, Kameyama S, Tanaka R. Peritumoral Edema and Seizure in Patients With Cerebral Convexity and Parasagittal Meningiomas. Neurol Med Chir (Tokyo) (1996) 36(8):568–73; discussion 73-4. doi: 10.2176/nmc.36.568
PubMed Abstract | CrossRef Full Text | Google Scholar
- Yoshioka H, Hama S, Taniguchi E, Sugiyama K, Arita K, Kurisu K. Peritumoral Brain Edema Associated With Meningioma: Influence of Vascular Endothelial Growth Factor Expression and Vascular Blood Supply. Cancer (1999) 85(4):936–44. doi: 10.1002/(sici)1097-0142(19990215)85:4<936::aid-cncr23>3.0.co;2-j
PubMed Abstract | CrossRef Full Text | Google Scholar
- Pistolesi S, Fontanini G, Camacci T, De Ieso K, Boldrini L, Lupi G, et al. Meningioma-Associated Brain Oedema: The Role of Angiogenic Factors and Pial Blood Supply. J Neurooncol (2002) 60(2):159–64. doi: 10.1023/a:1020624119944
PubMed Abstract | CrossRef Full Text | Google Scholar
- Hess K, Spille DC, Adeli A, Sporns PB, Brokinkel C, Grauer O, et al. Brain Invasion and the Risk of Seizures in Patients With Meningioma. J Neurosurg (2018) 130(3):789–96. doi: 10.3171/2017.11.JNS172265
PubMed Abstract | CrossRef Full Text | Google Scholar
- de Vries J, Wakhloo AK. Cerebral Oedema Associated With WHO-I, WHO-II, and WHO-III-Meningiomas: Correlation of Clinical, Computed Tomographic, Operative and Histological Findings. Acta Neurochir (Wien) (1993) 125(1-4):34–40. doi: 10.1007/BF01401825
PubMed Abstract | CrossRef Full Text | Google Scholar
- Chernov MF, Kasuya H, Nakaya K, Kato K, Ono Y, Yoshida S, et al. (1)H-MRS of Intracranial Meningiomas: What it can Add to Known Clinical and MRI Predictors of the Histopathological and Biological Characteristics of the Tumor? Clin Neurol Neurosurg (2011) 113(3):202–12. doi: 10.1016/j.clineuro.2010.11.008
PubMed Abstract | CrossRef Full Text | Google Scholar
- Spille DC, Hess K, Sauerland C, Sanai N, Stummer W, Paulus W, et al. Brain Invasion in Meningiomas: Incidence and Correlations With Clinical Variables and Prognosis. World Neurosurg (2016) 93:346–54. doi: 10.1016/j.wneu.2016.06.055
PubMed Abstract | CrossRef Full Text | Google Scholar
- Islim AI, McKeever S, Kusu-Orkar TE, Jenkinson MD. The Role of Prophylactic Antiepileptic Drugs for Seizure Prophylaxis in Meningioma Surgery: A Systematic Review. J Clin Neurosci (2017) 43:47–53. doi: 10.1016/j.jocn.2017.05.020
PubMed Abstract | CrossRef Full Text | Google Scholar
- Lu VM, Wahood W, Akinduro OO, Parney IF, Quinones-Hinojosa A, Chaichana KL. Four Independent Predictors of Postoperative Seizures After Meningioma Surgery: A Meta-Analysis. World Neurosurg (2019) 130:537–45 e3. doi: 10.1016/j.wneu.2019.06.063
PubMed Abstract | CrossRef Full Text | Google Scholar
- Wilson TA, Huang L, Ramanathan D, Lopez-Gonzalez M, Pillai P, De Los Reyes K, et al. Review of Atypical and Anaplastic Meningiomas: Classification, Molecular Biology, and Management. Front Oncol (2020) 10:565582. doi: 10.3389/fonc.2020.565582
PubMed Abstract | CrossRef Full Text | Google Scholar
- Tsuji M, Shinomiya S, Inoue R, Sato K. Prospective Study of Postoperative Seizure in Intracranial Meningioma. Jpn J Psychiatry Neurol (1993) 47(2):331–4. doi: 10.1111/j.1440-1819.1993.tb02094.x
PubMed Abstract | CrossRef Full Text | Google Scholar
- Li X, Wang C, Lin Z, Zhao M, Ren X, Zhang X, et al. Risk Factors and Control of Seizures in 778 Chinese Patients Undergoing Initial Resection of Supratentorial Meningiomas. Neurosurg Rev (2020) 43(2):597–608. doi: 10.1007/s10143-019-01085-5
PubMed Abstract | CrossRef Full Text | Google Scholar
- Hamasaki T, Yamada K, Yano S, Nakamura H, Makino K, Hide T, et al. Higher Incidence of Epilepsy in Meningiomas Located on the Premotor Cortex: A Voxel-Wise Statistical Analysis. Acta Neurochir (Wien) (2012) 154(12):2241–9. doi: 10.1007/s00701-012-1511-1
PubMed Abstract | CrossRef Full Text | Google Scholar
- McGovern SL, Aldape KD, Munsell MF, Mahajan A, DeMonte F, Woo SY. A Comparison of World Health Organization Tumor Grades at Recurrence in Patients With non-Skull Base and Skull Base Meningiomas. J Neurosurg (2010) 112(5):925–33. doi: 10.3171/2009.9.JNS09617
PubMed Abstract | CrossRef Full Text | Google Scholar
- Baumgarten P, Sarlak M, Baumgarten G, Marquardt G, Seifert V, Strzelczyk A, et al. Focused Review on Seizures Caused by Meningiomas. Epilepsy Behav (2018) 88:146–51. doi: 10.1016/j.yebeh.2018.09.002
PubMed Abstract | CrossRef Full Text | Google Scholar
- Zheng Z, Chen P, Fu W, Zhu J, Zhang H, Shi J, et al. Early and Late Postoperative Seizure Outcome in 97 Patients With Supratentorial Meningioma and Preoperative Seizures: A Retrospective Study. J Neurooncol (2013) 114(1):101–9. doi: 10.1007/s11060-013-1156-9
PubMed Abstract | CrossRef Full Text | Google Scholar
- Beghi E, Carpio A, Forsgren L, Hesdorffer DC, Malmgren K, Sander JW, et al. Recommendation for a Definition of Acute Symptomatic Seizure. Epilepsia (2010) 51(4):671–5. doi: 10.1111/j.1528-1167.2009.02285.x
PubMed Abstract | CrossRef Full Text | Google Scholar
- Baumgarten P, Sarlak M, Monden D, Spyrantis A, Bernatz S, Gessler F, et al. Early and Late Postoperative Seizures in Meningioma Patients and Prediction by a Recent Scoring System. Cancers (Basel) (2021) 13(3):450. doi: 10.3390/cancers13030450
PubMed Abstract | CrossRef Full Text | Google Scholar
- Joiner EF, Youngerman BE, Hudson TS, Yang J, Welch MR, McKhann GM, et al. Effectiveness of Perioperative Antiepileptic Drug Prophylaxis for Early and Late Seizures Following Oncologic Neurosurgery: A Meta-Analysis. J Neurosurg (2018) 130(4):1–9. doi: 10.3171/2017.10.JNS172236
PubMed Abstract | CrossRef Full Text | Google Scholar
- Raza SM, Gallia GL, Brem H, Weingart JD, Long DM, Olivi A. Perioperative and Long-Term Outcomes From the Management of Parasagittal Meningiomas Invading the Superior Sagittal Sinus. Neurosurgery (2010) 67(4):885–93; discussion 93. doi: 10.1227/NEU.0b013e3181ef2a18
PubMed Abstract | CrossRef Full Text | Google Scholar
- Scott DF. Left and Right Cerebral Hemisphere Differences in the Occurrence of Epilepsy. Br J Med Psychol (1985) 58( Pt 2):189–92. doi: 10.1111/j.2044-8341.1985.tb02633.x
PubMed Abstract | CrossRef Full Text | Google Scholar
- Islim AI, Ali A, Bagchi A, Ahmad MU, Mills SJ, Chavredakis E, et al. Postoperative Seizures in Meningioma Patients: Improving Patient Selection for Antiepileptic Drug Therapy. J Neurooncol (2018) 140(1):123–34. doi: 10.1007/s11060-018-2941-2
PubMed Abstract | CrossRef Full Text | Google Scholar
- Komotar RJ, Raper DM, Starke RM, Iorgulescu JB, Gutin PH. Prophylactic Antiepileptic Drug Therapy in Patients Undergoing Supratentorial Meningioma Resection: A Systematic Analysis of Efficacy. J Neurosurg (2011) 115(3):483–90. doi: 10.3171/2011.4.JNS101585
PubMed Abstract | CrossRef Full Text | Google Scholar
- Zada G, Pagnini PG, Yu C, Erickson KT, Hirschbein J, Zelman V, et al. Long-Term Outcomes and Patterns of Tumor Progression After Gamma Knife Radiosurgery for Benign Meningiomas. Neurosurgery (2010) 67(2):322–8; discussion 8-9. doi: 10.1227/01.NEU.0000371974.88873.15
PubMed Abstract | CrossRef Full Text | Google Scholar
- Pollock BE, Stafford SL, Link MJ, Garces YI, Foote RL. Single-Fraction Radiosurgery for Presumed Intracranial Meningiomas: Efficacy and Complications From a 22-Year Experience. Int J Radiat Oncol Biol Phys (2012) 83(5):1414–8. doi: 10.1016/j.ijrobp.2011.10.033
PubMed Abstract | CrossRef Full Text | Google Scholar
- Glantz MJ, Cole BF, Forsyth PA, Recht LD, Wen PY, Chamberlain MC, et al. Practice Parameter: Anticonvulsant Prophylaxis in Patients With Newly Diagnosed Brain Tumors. Report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology (2000) 54(10):1886–93. doi: 10.1212/WNL.54.10.1886
PubMed Abstract | CrossRef Full Text | Google Scholar
- Zhang B, Zhao G, Yang HF, Wang D, Yu JL, Huang HY. Assessment of Risk Factors for Early Seizures Following Surgery for Meningiomas Using Logistic Regression Analysis. J Int Med Res (2011) 39(5):1728–35. doi: 10.1177/147323001103900515
PubMed Abstract | CrossRef Full Text | Google Scholar
- Harward SC, Rolston JD, Englot DJ. Seizures in Meningioma. Handb Clin Neurol (2020) 170:187–200. doi: 10.1016/B978-0-12-822198-3.00053-7
PubMed Abstract | CrossRef Full Text | Google Scholar
- Gloss D, Pargeon K, Pack A, Varma J, French JA, Tolchin B, et al. Antiseizure Medication Withdrawal in Seizure-Free Patients: Practice Advisory Update Summary: Report of the AAN Guideline Subcommittee. Neurology (2021) 97(23):1072–81. doi: 10.1212/WNL.0000000000012944
PubMed Abstract | CrossRef Full Text | Google Scholar
- Guerrini R, Rosati A, Giordano F, Genitori L, Barba C. The Medical and Surgical Treatment of Tumoral Seizures: Current and Future Perspectives. Epilepsia (2013) 54:84–90. doi: 10.1111/epi.12450
PubMed Abstract | CrossRef Full Text | Google Scholar
- Klein M. Neurocognitive Functioning in Adult WHO Grade II Gliomas: Impact of Old and New Treatment Modalities. Neuro Oncol (2012) 14:17–24. doi: 10.1093/neuonc/nos161
CrossRef Full Text | Google Scholar
- Maschio M, Dinapoli L, Sperati F, Pace A, Fabi A, Vidiri A, et al. Effect of Pregabalin Add-on Treatment on Seizure Control, Quality of Life, and Anxiety in Patients With Brain Tumour-Related Epilepsy: A Pilot Study. Epileptic Disord (2012) 14(4):388–97. doi: 10.1684/epd.2012.0542
PubMed Abstract | CrossRef Full Text | Google Scholar
- van der Meer PB, Dirven L, Fiocco M, Vos MJ, Kouwenhoven MCM, van den Bent MJ, et al. First-Line Antiepileptic Drug Treatment in Glioma Patients With Epilepsy: Levetiracetam vs Valproic Acid. Epilepsia (2021) 62(5):1119–29. doi: 10.1111/epi.16880
PubMed Abstract | CrossRef Full Text | Google Scholar
- van der Meer PB, Dirven L, van den Bent MJ, Preusser M, Taphoorn MJB, Rudá R, et al. Prescription Preferences of Antiepileptic Drugs in Brain Tumor Patients: An International Survey Among EANO Members. Neuro-Oncol Pract (2021) 9(2):105–13. doi: 10.1093/nop/npab059
CrossRef Full Text | Google Scholar
- Jenkinson M, Helmy A, Huckey H, Mills S, Grant R, Hughes D, et al. Surgeons Trial Of Prophylaxis For Epilepsy In Seizure Naïve Patients With Meningioma: A Randomized Controlled Trial (STOP ‘Em). Neuro-Oncol Pract (2020) 22(Supplement_2):ii195. doi: 10.1093/neuonc/noaa215.815
CrossRef Full Text | Google Scholar





